TNFR1、TNFR2 预测维持性血液透析患者预后的价值
钟晓容 杨 枫
福建省福州市第一医院肾内科,福建福州 350009
[摘要] 目的 探讨肿瘤坏死因子受体1(TNFR1)和肿瘤坏死因子受体2(TNFR2)预测维持性血液透析(MHD)患者全因死亡和心血管死亡风险的价值。 方法 前瞻性随访2019 年3 月1 日至4 月1 日福州市第一医院血液净化中心的300 例MHD 患者2 年,按照终点存活和死亡分为存活组(245 例)和死亡组(55 例)。 收集患者基线资料,采用双抗体夹心ABC-ELISA 法测定TNFRl、TNFR2, 观察的终点事件为患者全因死亡及心血管死亡。 采用Cox 回归分析法分析患者全因死亡、心血管死亡的独立危险因素。 采用受试者工作特征(ROC)曲线及约登指数评判TNFR1、TNFR2 对MHD 患者全因死亡、心血管死亡的预测价值。 结果 死亡组的年龄大于存活组,透析时间长于存活组,收缩压、TNFR1、TNFR2 水平高于存活组,白蛋白水平低于存活组,差异有统计学意义(P<0.05)。 300 例MHD 患者中,有55 例(18.33%)患者死亡,其中心血管疾病死亡20 例(36.36%)。 多变量Cox 回归分析结果显示,TNFR1(β=0.018,OR=1.018,95%CI=11.015~1.021)、TNFR2(β=0.007,OR=1.007,95%CI=1.005~1.009)是 MHD 患者全因死亡的独立危险因素(P<0.01);TNFR1(β=0.016,OR=1.016,95%CI=1.011~1.021)、TNFR2(β=0.007,OR=1.007,95%CI=1.004~1.011)是 MHD 患者心血管死亡的独立危险因素(P<0.01)。 TNFR1、TNFR2 预测 MHD 患者全因死亡的 AUC 分别为 0.970、0.938,预测心血管死亡的 AUC 分别为 0.905、0.881。 结论 TNFR1、TNFR2 浓度升高与MHD 患者预后密切相关,对MHD 患者预后的判断具有重要价值。
[关键词]肿瘤坏死因子受体1;肿瘤坏死因子受体2;血液透析;预后
肿瘤坏死因子受体(tumor necrosis factor receptor,TNFR)与肿瘤坏死因子(tumor necrosis factor α,TNF-α)结合介导促炎症反应,激活了免疫应答以及细胞凋亡的信号通路[1]。 近期的研究发现,循环中的TNFR1 和TNFR2 与糖尿病患者肾脏疾病进展[2-3]、心血管事件和死亡率较高的风险独立相关[4-5]。在危重症合并急性肾脏损伤患者中, 循环中TNFR1 水平的升高与其肾脏恢复缓慢和死亡的风险增加明显相关[6]。 在血液透析患者中,TNFR 是全因死亡率的重要独立预测因子[7],TNFRs 水平升高与血液透析患者的心血管和(或)全因死亡率的风险相关[8]。另外,有研究发现循环肿瘤坏死因子受体 (circulating tumor necrosis factor receptor,cTNFR)水平与死亡率之间无关联[9]。目前,血液透析患者TNFRs 水平与死亡率之间的关系仍存争议。本研究的目标是在一项基于血液透析人群的前瞻性研究中调查血浆TNFR1 和TNFR2 水平升高是否与远期死亡风险相关,探讨TNFR1 和TNFR2 预测维持性血液透析(maintenance hemodialysis,MHD)患者全因死亡和心血管疾病死亡风险的价值。
1 资料与方法
1.1 一般资料
选取2019 年 3 月 1 日至 4 月 1 日福州市第一医院血液净化中心的300 例MHD 患者。排除标准:①年龄<18 岁;②进入透析时间<3 个月;③随访期间转入其他中心致失访;④既往恶性肿瘤等。 所有患者均采用间歇性血液透析,每周2~3 次,每次4 h。 采用血液透析机(威高,DBB-27)、一次性使用威高聚砜膜透析器(F16)、碳酸氢盐透析液进行血液透析,血流量、透析液流量分别为 250~300、500 ml/min; 以动静脉内瘘或半永久长期透析导管为血管通路, 采用普通肝素或低分子肝素钠抗凝。 原发病包括慢性肾小球肾炎 104例(34.67%),糖尿病肾病 93 例(31%),高血压肾病 63例(21%),多囊肾 12 例(4.0%),其他 28 例(9.33%)。 按照终点存活和死亡将入选患者分为存活组(245 例)和死亡组(55 例)。本研究通过医院伦理委员会批准,所有入选患者均签订知情同意书。
1.2 方法
收集入组患者的基线资料,包括年龄、性别、透析龄、身高、体重、血压、原发病、并发症等。 所有患者均在入组首次透析前空腹采血,检测血常规、生化、甲状旁腺素(parathyroid hormone,PTH)、铁蛋白、C 反应蛋白、TNFR1、TNFR2 水平等。 TNFR1/TNFR2 ELISA 试剂盒购自福州硕博生物技术有限公司(201903)。计划性随访所有患者2 年, 每3 个月检测血常规、 生化、PTH 水平等, 根据检查结果评估并调整透析处方,加强贫血的管理、营养的指导,纠正钙磷代谢,控制高血压等。观察的终点事件为患者全因死亡及心血管疾病死亡, 其中心血管疾病死亡原因包括充血性心力衰竭、急性缺血性心脏病、严重心律失常等。
1.3 统计学方法
采用SPSS 19.0 统计软件处理所有数据, 计量资料用均数±标准差(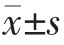 )表示,方差齐者采用One-Way ANOVA 分析,计数资料以频数和百分率(%)比较,采用χ2 检验。 采用Cox 回归分析法分析患者全因死亡、心血管死亡的独立危险因素。采用受试者工作特征曲线(receiver operating characteristic,ROC)及约登指数评判 TNFR1、TNFR2 对 MHD 患者全因死亡、 心血管死亡的预测价值。以α=0.05 作为检验水准,以P<0.05为差异有统计学意义。
)表示,方差齐者采用One-Way ANOVA 分析,计数资料以频数和百分率(%)比较,采用χ2 检验。 采用Cox 回归分析法分析患者全因死亡、心血管死亡的独立危险因素。采用受试者工作特征曲线(receiver operating characteristic,ROC)及约登指数评判 TNFR1、TNFR2 对 MHD 患者全因死亡、 心血管死亡的预测价值。以α=0.05 作为检验水准,以P<0.05为差异有统计学意义。
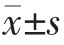 )表示,方差齐者采用One-Way ANOVA 分析,计数资料以频数和百分率(%)比较,采用χ2 检验。 采用Cox 回归分析法分析患者全因死亡、心血管死亡的独立危险因素。采用受试者工作特征曲线(receiver operating characteristic,ROC)及约登指数评判 TNFR1、TNFR2 对 MHD 患者全因死亡、 心血管死亡的预测价值。以α=0.05 作为检验水准,以P<0.05为差异有统计学意义。
)表示,方差齐者采用One-Way ANOVA 分析,计数资料以频数和百分率(%)比较,采用χ2 检验。 采用Cox 回归分析法分析患者全因死亡、心血管死亡的独立危险因素。采用受试者工作特征曲线(receiver operating characteristic,ROC)及约登指数评判 TNFR1、TNFR2 对 MHD 患者全因死亡、 心血管死亡的预测价值。以α=0.05 作为检验水准,以P<0.05为差异有统计学意义。2 结果
2.1 两组患者基线临床资料的比较
本研究共纳入300 例MHD 患者,死亡组的年龄大于存活组,透析龄长于存活组,差异有统计学意义(P<0.05)。 死亡组的收缩压、糖尿病患者比例及TNFR1、TNFR2、CRP 水平高于存活组,血红蛋白、白蛋白水平低于存活组,差异有统计学意义(P<0.05)。 两组的其他因素比较,差异无统计学意义(P>0.05)(表l)。
2.2 随访结局和死亡原因
300 例 MHD 患者至随访终点,有 55 例(18.33%)患者死亡,其中心血管疾病死亡20 例(36.36%),包括心力衰竭10 例,冠心病7 例,心源性猝死3 例;其他死亡原因包括脑卒中 15 例(27.27%),感染 9 例(16.36%),多脏器功能衰竭 4 例(7.27%),恶性肿瘤2例(3.6%),死因不明 5 例(9.09%)。
2.3 全因死亡及心血管疾病死亡的危险因素分析
以是否有死亡为因变量(赋值:有=1,无=0),选择性别(赋值:男=1,女=0)、年龄(赋值:>65 岁=1,≤65岁=0)、高血压(赋值:有=1,无=0)、糖尿病(赋值:有=1,无=0)。多变量 Cox 回归分析结果显示,TNFR1、TNFR2、ALB、年龄大、透龄长是MHD 患者全因死亡的独立危险因素(P<0.01),TNFR1、TNFR2、LDL、透龄长、有糖尿病病史是MHD 患者心血管死亡的独立危险因素(P<0.01)。
2.4 TNFR1、TNFR2 预测 MHD 患者全因死亡和心血管疾病死亡的生存价值
TNFR1 预测MHD 患者全因死亡的ROC 曲线下面积为0.970,约登指数为0.835,预测患者心血管疾病死亡的敏感性为94.52%,特异性为89.00%;心血管疾病死亡的ROC 曲线下面积为0.905, 约登指数为0.678,预测患者心血管疾病死亡的敏感性为90.00%,特异性为77.83%。
TNFR2 预测MHD 患者全因死亡的ROC 曲线下面积为0.938,约登指数为0.778,预测患者心血管疾病死亡的敏感性为98.17%,特异性为 79.60%;心血管疾病死亡的ROC 曲线下面积为0.881,约登指数为0.679, 预测患者心血管疾病死亡的敏感性为95.00%,特异性为 72.86%(表 4、表 5)。
表4 TNFR1、TNFR2 预测MHD 患者全因死亡的生存价值
.jpg)
表5 TNFR1、TNFR2 预测MHD 患者心血管疾病死亡的生存价值
.jpg)
表1 两组患者基线临床资料的比较
.jpg)
表2 MHD 患者全因死亡的Cox 回归分析
.jpg)
表3 MHD 患者心血管死亡的Cox 回归分析
.jpg)
3 讨论
本研究对 300 例 MHD 患者基线 TNFR1、TNFR2水平与生存率的关系进行分析,在校正各种混杂因素后发现, 相对较高水平的 TNFR1、TNFR2 是 MHD 患者全因死亡、心血管死亡的独立危险因素。
TNFR1 和TNFR2 是Ⅰ型跨膜蛋白, 其特征在于胞外域中富含半胱氨酸, 而细胞内片段没有同源序列,并激活不同的信号通路[9]。 TNFR1 在大多数细胞中表达,介导TNF-α 的促炎症作用,包含1 个死亡域并激活外源性细胞凋亡。 相反,TNFR2 仅表达于较少的细胞类型,与内皮细胞增殖和迁移有关[10]。
迄今为止, 许多研究者已经证明TNF 途径参与了各种类型的肾脏疾病的发病机制[11-12],并且TNF 相关的生物标志物也与蛋白尿或肾小球滤过率(glomerular filtration rate,GFR)[13]的水平有关。 然而,关于TNF 相关的生物标志物是否能预测血液透析患者的预后知之甚少。 最近,Carlsson 等[14]报道,cTNFR水平不能预测207 例血液透析患者的死亡率。与其结果形成鲜明对比的是,本研究结果支持先前发现的相对较高的cTNFR 水平与各种疾病(包括糖尿病肾病,甚至社区性疾病)的死亡率之间存在关联[15-16],其研究与笔者研究之间的争议可能是由于以下原因。①由于用于TNFR 测量的ELISA 试剂盒不同,因此很难对这些结果进行简单比较;②西方血液透析患者的死亡率可能与TNFRs 以外的其他因素密切相关, 因为在血液透析患者中观察到相当大的死亡率差异。
白蛋白水平是反映透析患者营养状态的最经典指标, 本研究死亡组患者的白蛋白显著低于存活组,且与存活组相比,年龄更大、透析时间更长,是MHD患者全因死亡的独立危险因素及透析患者长期预后的影响因素,也是死亡率增高的重要原因。
最近的荟萃分析支持循环中TNFR1 和TNFR2的增加是糖尿病患者心血管事件和死亡率的独立预测因子[4]。 糖尿病并发症发生的重要病理生理机制之一是炎症, 而在这些炎症途径中,TNFR 信号途径在炎症激活中起重要作用[17-18]。 糖尿病MHD 患者通常也处于慢性炎症状态,可能通过血管内皮功能障碍和血管钙化,进而导致动脉粥样硬化、心血管事件的发生,增加心血管死亡风险。 本研究也证实了TNFR 与心血管事件和死亡率之间的关系。
本研究为前瞻性研究设计,在终点事件之前收集血样和危险因素。当然,本研究也存在一些限制,即使对终点事件的主要危险因素进行了调整,但仍然可能存在残留混杂因素。笔者为单中心数据,缺乏多中心数据。另外,本研究只检测 MHD 患者 TNFR1、TNFR2 的基线水平,未对TNFR1、TNFR2 进行动态观察,存在局限性,不能准确地反映TNFR1、TNFR2 随时间的变化趋势。
综上所述,MHD 患者的预后与TNFR 浓度升高密切相关,TNFR1、TNFR2 可独立于其他因素预测MHD 患者全因死亡及心血管死亡,对MHD 患者预后的判断具有重要价值。密切监测循环TNFR 水平较高的MHD 患者,加强对该类患者监测,提供相应的干预措施,可以改善患者预后,提高患者的生存质量。
[参考文献]
[1]So T,Ishii N.The TNF-TNFR family of co-signal molecules[J].Adv Exp Med Biol,2019,1189:53-84.
[2]Murakoshi M,Gohda T,Suzuki Y.Circulating tumor necrosis factor receptors:a potential biomarker for the progression of diabetic kidney disease[J].Int J Mol Sci,2020,21(6):1957.
[3]Ye X,Luo T,Wang K,et al.Circulating TNF receptors 1 and 2 predict progression of diabetic kidney disease:a metaanalysis[J].Diabetes Metab Res Rev,2019,35(8):e3195.
[4]Cheng Y,Fei Y,Saulnier PJ,et al.Circulating TNF receptors and risk of renal disease progression,cardiovascular disease events and mortality in patients with diabetes:a systematic review and meta-analysis[J].Endocrine,2020,68(1):32-43.
[5]Carlsson AC,Ruge T,Kjoller E,et al.10-year associations between tumor necrosis factor receptors 1 and 2 and cardiovascular events in patients with stable coronary heart disease:a CLARICOR (effect of Clarithromycin on mortality and morbidity in patients with ischemic heart disease) trial substudy[J].J Am Heart Assoc,2018,7(9):e008299.
[6]Neirynck N,Glorieux G,Schepers E,et al.Soluble tumor necrosis factor receptor 1 and 2 predict outcomes in advanced chronic kidney disease:a prospective cohort study[J].PLoS One,2015,10(3):e0122073.
[7]Murugan R,Wen X,Shah N,et al.Plasma inflammatory and apoptosis markers are associated with dialysis dependence and death among critically ill patients receiving renal replacement therapy[J].Nephrol Dial Transplant,2014,29(10):1854-1864.
[8]Gohda T,Maruyama S,Kamei N,et al.Circulating TNF receptors 1 and 2 predict mortality in patients with end-stage renal disease undergoing dialysis[J].Sci Rep,2017,7:43520.
[9]Murakoshi M,Gohda T,Suzuki Y.Circulating tumor necrosis factor receptors:a potential biomarker for the progression of diabetic kidney disease[J].Int J Mol Sci,2020,21(6):1957.
[10]Bemelmans MHA,van Tits LJH,Buurman WA.Tumor necrosis factor:function,release and clearance[J].Crit Rev Immunol,2017,37(2-6):249-259.
[11]Omote K,Gohda T,Murakoshi M,et al.Role of the TNF pathway in the progression of diabetic nephropathy in KKA(y) mice[J].Am J Physiol Renal Physiol,2014,306(11):F1335-F1347.
[12]Taubitz A,Schwarz M,Eltrich N,et al.Distinct contributions of TNF receptor 1 and 2 to TNF-α induced glomerular in ammation in mice[J].PLoS One,8(7):e68167.
[13]Neirynck N,Glorieux G,Schepers E,et al.Soluble tumor necrosis factor receptor 1 and 2 predict outcomes in advanced chronic kidney disease:a prospective cohort study[J].PLoS One,2015,10(3):e0122073.
[14]Carlsson AC,Carrero JJ,Stenvinkel P,et al.High levels of soluble tumor necrosis factor receptors 1 and 2 and their association with mortality in patients undergoing hemodialysis[J].Cardiorenal Med,2015,5(2):89-95.
[15]Saulnier PJ,Gand E,Ragot S,et al.Association of serum concentration of TNFR1 with all-cause mortality in patients with type 2 diabetes and chronic kidney disease:follow-up of the SURDIAGENE Cohort[J].Diabetes Care,2014,37(5):1425-1431.
[16]Lee JE,Gohda T,Walker WH,et al.Risk of ESRD and all cause mortality in type 2 diabetes according to circulating levels of FGF-23 and TNFR1[J].PLoS One,2013,8(3):e58007.
[17]Al-Lamki RS,Mayadas TN.TNF receptors:signaling pathways and contribution to renal dysfunction[J].Kidney Int,2015,87(2):281-296.
[18]Niewczas MA,Pavkov ME,Skupien J,et al.A signature of circulating inflammatory proteins and development of endstage renal disease in diabetes[J].Nat Med,2019,25(5):805-813.
Prognostic value of TNFR1 and TNFR2 in predicting of patients with maintenance hemodialysis
ZHONG Xiao-rong YANG Feng
Department of Nephrology, Fuzhou First Hospital, Fujian Province, Fuzhou 350009, China
Department of Nephrology, Fuzhou First Hospital, Fujian Province, Fuzhou 350009, China
[Abstract] Objective To investigate the value of tumor necrosis factor receptor 1 (TNFR1) and tumor necrosis factor receptor 2 (TNFR2) in predicting the risk of all-cause death and cardiovascular death in maintenance hemodialysis(MHD) patients. Methods A total of 300 MHD patients in the Blood Purification Center of Fuzhou First Hospital from March 1 to April 1, 2019 were prospectively followed up for 2 years. According to the endpoint survival and death, they were diveded into the survival group (245 cases) and the death group (55 cases). The baseline data were collected.TNFR1 and TNFR2 were measured by double antibody sandwich ABC-ELISA. The end points events were all-cause death and cardiovascular deaths. Cox regression analysis was used to analyze the independent risk factors of all-cause mortality and cardiovascular mortality. Receiver operating characteristic (ROC) curve and Youden index were used to evaluate the predictive value of TNFR1 and TNFR2 on all-cause death and cardiovascular death in MHD patients.Results The age of the death group was older than that of the survival group, the dialysis time of the death group was longer than that of the survival group, the levels of systolic blood pressure, TNFR1 and TNFR2 of the death group were higher than those of the survival group, and the level of albumin of the death group was lower than that of the survival group, the differences were statistically significant (P<0.05). Among the 300 MHD patients, 55 cases (18.33%) died,included 20 (36.36%) from cardiovascular disease. Multivariate Cox regression analysis showed that TNFR1 (β=0.018,OR=1.018, 95%CI=11.015-1.021), TNFR2 (β=0.007, OR=1.007, 95%CI=1.005-1.009) were independent risk factors for all-cause death in MHD patients (P<0.01); TNFR1 (β=0.016, OR=1.016, 95%CI=1.011-1.021), TNFR2 (β=0.007,OR=1.007, 95%CI=1.004-1.011) were independent risk factors for cardiovascular death in MHD patients (P<0.01). The AUC of TNFR1 and TNFR2 predicting all-cause death in MHD patients were 0.970 and 0.938, respectively, and the AUC predicting cardiovascular death were 0.905 and 0.881, respectively. Conclusion The elevated concentrations of TNFR1 and TNFR2 are closely related to the prognosis of MHD patients, and which are of great value in judging the prognosis of MHD patients
[Key words] Tumor necrosis factor receptor 1; Tumor necrosis factor receptor 2; Hemodialysis; Prognosis
[中图分类号] R459.5
[文献标识码] A
[文章编号] 1674-4721(2021)12(a)-0094-04
[基金项目]福建省福州市科技计划项目(2019-S-71)。
[作者简介]钟晓容(1982-),女,福建古田人,硕士,研究方向:慢性肾脏病学。
(收稿日期:2021-08-04)