蒙药阿拉嘎斑布有效成分对肝癌HepG2 细胞作用机制的研究
马世琦1 邓秀玲2 吴亚男2 韩晶晶3 赵 阳2 乔一芸2 王海生2▲
1.内蒙古自治区中医医院门诊办公室,内蒙古呼和浩特 010020;2.内蒙古医科大学基础医学院生物化学与分子生物学系,内蒙古呼和浩特 010110;3.内蒙古医科大学基础医学院医学实验中心,内蒙古呼和浩特 010110
[摘要] 目的 探讨蒙药阿拉嘎斑布的有效成分斑蝥素(CTD)对肝癌抑制的分子机制。 方法 使用课题组提取获得的CTD 研究其对HepG2 细胞增殖、凋亡、周期等细胞功能的影响。 通过转录组测序技术进行测序,研究其对HepG2细胞mRNA 基因表达的影响。 结果 MTT 结果显示CTD 对HepG2 细胞的增殖具有抑制作用。 流式细胞术分析显示CTD 可诱导HepG2 阻滞于G2/M 期,同时Caspase 3/7 荧光检测法显示其具有诱导HepG2 凋亡的作用。RNA 测序筛选出18 个显著差异表达的mRNA 基因。 结论 阿拉嘎斑布的提取物CTD 可促进凋亡、触导细胞周期阻滞以抑制肝癌细胞,并可通过影响mRNA 差异表达,进而影响HepG2 的生物学行为,而这些差异表达的mRNA 基因或许可成为肝癌早期预测和治疗的靶点。
[关键词]阿拉嘎斑布;斑蝥素;肝癌;肿瘤抑制;mRNA
肝细胞癌(hepatocellular carcinoma,HCC)是最常见的肝癌组织学亚型,占全世界原发性肝癌的80%以上[1]。 在全球范围内,HCC 是与癌症相关死亡的第四大最常见原因,其五年生存率仅为18%,是仅次于胰腺癌的第二大致命肿瘤[2-3]。 由于大部分HCC 患者发现时已处于进展期,而全身化疗的中位生存时间也不到1 年,治疗效果不理想[4]。阿拉嘎斑布是我国的传统蒙药,是芫菁科昆虫的干燥虫体,其具有破血逐瘀、散结消癥、滋补肾阳、调理体素、增强抵抗力等功效[5],其有效药物成分主要为斑蝥素(cantharidin,CTD),分子式C10H12O4,分子量196.2 D。 有关CTD 的提取方法不尽相同,主要有震荡静置提取法、超声波震荡提取法、冷浸提取法、碱水提取法、热回流提取法等[6-9]。有文献报道,芫菁虫体不同部位的CTD 产率有差别,其中产率最高的部位为虫体的腹部,并且发现干燥虫体较活体虫体能获得更多的CTD[10]。CTD 对多种人类恶性肿瘤均表现出显著的抗癌活性,如对喉癌、肾癌、肺癌、肝癌、胃癌、皮肤癌等多种肿瘤的生长表现出明显的抑制作用[11-14]。但是,CTD 对肝癌抑制作用的具体分子机制目前仍不完全清楚。本研究选用蒙药阿拉嘎斑布虫体作为研究药物,使用课题组前期通过混合法提取的CTD 作为实验用药,研究其对HepG2 细胞的影响,并通过RNA 测序, 尝试从分子水平及基因表达谱的角度对CTD 治疗肝癌的分子机制进行研究, 为蒙药用于肝癌的治疗提供新的线索和依据。
1 材料与方法
1.1 细胞与主要试剂
HepG2 细胞株购自武汉普诺赛生物科技有限公司;阿拉嘎斑布干燥虫体购自内蒙古自治区中医医院;胎牛血清购自美国GIBCO 公司;CTD 标准品及PI细胞周期检测试剂盒购自西格玛奥德里奇上海贸易有限公司;MTT 试剂盒购自北京鼎国昌盛生物技术有限责任公司;Caspase-Glo R 3/7 检测试剂盒购自普洛麦格北京生物技术有限公司;RNAiso Plus Total RNA 提取试剂盒等。
1.2 方法
1.2.1 细胞培养 本研究所用的HepG2 细胞株, 于含有10%胎牛血清、1%青链霉素双抗的DMEM 完全培养液中进行培养,根据细胞生长状态,2~3 d 传代一次。
1.2.2 CTD 母液的配制 将课题组前期提取的CTD 白色粉末用含1‰二甲基亚砜(dimethyl sulfoxide,DMSO)的DMEM 基础培养液进行超声溶解配制母液, 使用时再用完全培养液稀释至所需浓度。
1.2.3 实验分组设置 空白对照组(Blank):不含细胞,加只含有1‰ DMSO 药物溶剂的完全培养液;溶剂对照组(Mock):含正常目的细胞,加只含有1‰ DMSO药物溶剂的完全培养液;实验组(CTD):含正常目的细胞,加含有相应浓度CTD 的含药培养液。
1.2.4 MTT 法检测增殖 于3 块96 孔板内接种细胞,每组三个复孔,孵育24 h 后加药处理,分别于24、48、72 h 后检测光密度(optical density,OD)值。 实验分为Blank 组、Mock 组和 CTD 组, 其中 CTD 组的浓度分别为 0.05、0.1、0.5、1、2、4、8、16、32、64、128、256、512、1024 μmol/L。使用 Graphpad prism 5 软件进行半抑制浓度(half maximal inhibitory concentration,IC50)数值计算。
1.2.5 Caspase 3/7 荧光法检测凋亡 于96 孔板内接种细胞,每组三个复孔,孵育48 h 后加药处理,48 h后加Caspase 3/7 反应液检测。 实验分组同1.2.4。
1.2.6 流式细胞仪PI 单染法检测细胞周期 于6 孔板内接种细胞,每组三个复孔,孵育24 h 后加药处理,48 h 后收集细胞,于4℃冰箱固定24 h,加入Rnase A溶液和PI 染色液后上机检测。 实验分为Mock 组和CTD 组,实验重复 3 次。
1.2.7 测序技术检测差异表达的mRNA 收集足量细胞,采用Trizol 法提取总RNA 后进行建库,质检合格后,采用Illumina 测序平台进行RNA seq,随后进行差异基因筛选,并进行富集分析。
1.3 统计学方法
采用SPSS 17.0 统计学软件和GraphPad Prism 5进行数据分析,计量资料用均数±标准差(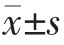 )表示,两组间比较采用t 检验,以P<0.05 为差异有统计学意义。
)表示,两组间比较采用t 检验,以P<0.05 为差异有统计学意义。
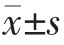 )表示,两组间比较采用t 检验,以P<0.05 为差异有统计学意义。
)表示,两组间比较采用t 检验,以P<0.05 为差异有统计学意义。2 结果
2.1 MTT 法检测结果
检测结果见图1。CTD 对HepG2 的抑制呈现一定程度的剂量-时间依赖,且 24、48、72 h 的 IC50 分别为54.420、9.892、4.132 μmol/L,48 h 对应曲线的线性效果最佳。因此,参考 48 h 的 IC50 值,将 10 μmol/L 作为后续实验的CTD 药物浓度。
.jpg)
图1 CTD 作用于HepG2 的剂量反应曲线
2.2 Caspase 3/7 荧光法检测结果
Caspase 3/7 荧光法检测结果见图2。结果表明,加药作用 48 h 后,MOCK 组荧光强度为 7661.67±108.87,CTD 组为 24 310.00±305.50,与 MOCK 组比较,CTD组荧光强度有明显的增强, 差异有统计学意义(P<0.01),CTD 是 HepG2 凋亡的有效诱导物。
.jpg)
图2 CTD 对HepG2 细胞凋亡的影响
2.3 流式细胞仪PI 单染法检测的 CTD 对HepG2 细胞周期的影响
流式细胞仪PI 单染法检测结果见图3(封三)。与MOCK 组比较, 加药作用 48 h 后,G0/G1 期和 S 期下降,差异均有统计学意义(P<0.05),而 G2/M 期则明显上升,差异有统计学意义(P<0.01),CTD 可将 HepG2细胞周期阻滞于G2/M 期。
.jpg)
图3 CTD 对HepG2 细胞周期的影响
2.4 测序技术检测 CTD 对 HepG2 细胞 mRNA 差异表达谱的影响
2.4.1 差异基因筛选结果 mRNA 差异基因统计结果见图4(封四)。 当差异基因筛选的阈值为|log2(Fold Change)|>2 且 Padj<0.05 时 ,mRNA 差 异 基 因 共 计6293 个,其中5694 个差异表达水平升高,599 个差异表达水平下降。
.jpg)
2.4.2 差异基因富集分析结果 差异mRNA 靶基因的GO 功能富集和KEGG 通路富集结果分别见图5~6(封四),筛选条件均为 Padj<0.05。 GO 功能富集选择显著性最明显的一个注释, 即为endoplasmic reticulum lumen(P<0.05),属于 cellular component 类目。KEGG通路富集主要富集在p53 signaling pathway、PI3KAkt signaling pathway、Apoptosis、MicroRNAs in cancer以及多种代谢途径(P<0.05),差异基因可能通过这些不同的功能及通路调控HepG2 细胞的生物进程。 对于以上筛选出的显著差异表达mRNA,通过大量的查阅文献并结合GO 功能富集和KEGG 通路富集分析,以及按照差异基因相对表达量的变化倍数从高到低进一步筛选出mRNA 共计18 个基因,其中14 个基因表达水平上调,4 个基因表达水平下调, 结果见表1,这些基因在CTD 作用于HepG2 细胞时可能发挥关键作用。
表1 显著差异表达的mRNA 基因汇总表
.jpg)
.jpg)
.jpg)
3 讨论
本研究将阿拉嘎斑布的有效成分CTD 选为研究药物,以HepG2 细胞为研究对象,先后从CTD 作用于HepG2 细胞后的细胞增殖、凋亡和周期分布三个角度进行了实验研究,结果显示,CTD 可显著抑制HepG2的增殖,其机制可能与诱导凋亡和触发细胞周期阻滞于G2/M 期有关。
为了进一步研究CTD 抑制肝癌的作用机制,本研究采用RNA-seq 测序技术, 从mRNA 基因差异表达谱的角度研究CTD 抑制肝癌的分子机制。 最终筛选出18 个显著差异表达的mRNA, 这些基因参与调控多种信号通路如p53 信号通路、PI3K-Akt 信号通路、p38-MAPK 信号通路等。
双特异性磷酸酶(dual specificity phosphatase,DUSP)、CDKN1A 和 CDK1 是以上筛选出的显著差异表达的mRNA。DUSP 属于酪氨酸磷酸酶中的亚家族,其在体内可参与调控多种信号途径, 与肿瘤关系密切[15-16]。 DUSP1 是 DUSP 的家族成员之一, 研究表明DUSP1 可通过对MAPK 信号通路进行负性调控从而对肝癌细胞的增殖进行抑制[17-19],提示DUSP1 在肝癌中发挥的是抑癌作用, 与本研究的测序结果一致,即用 CTD 处理 HepG2 细胞后, 与对照组比较,CTD 组的DUSP1 mRNA 表达水平上调, 可以推测DUSP1 在CTD 的抗肝癌过程中发挥重要作用。
CDKN1A,又名P21,是细胞周期依赖性蛋白激酶(cyclin-dependent kinase,CDK)的抑制剂,其对细胞周期的调控具有关键作用[20-21]。 研究发现,CDK1 是CDKN1A 的重要靶标,CDKN1A 通过下调CDK1 使其活性受到抑制,从而将细胞周期阻滞于G2/M 期[22]。 这表明CDKN1A 和CDK1 在调控细胞周期阶段转化中起关键作用,与本研究的结果一致,即将CTD 作用于HepG2 细胞后,与对照组比较,CTD 组 HepG2 细胞被阻滞于G2/M 期,且 CTD 组的CDKN1A mRNA 表达水平上调, 而CDK1 mRNA 表达水平下调, 提示CDKN1A 对CDK1 的负性调控可能是CTD 将 HepG2 细胞阻滞于G2/M 期的重要环节。
以上这些基因中,一部分已经有文献报道其与肝癌或者其他肿瘤在分子机制上的关系,但绝大多数均未从CTD 的角度进行过分析研究, 而本研究目前的结果已表明这些基因可能会是CTD 抑制肝癌的重要应答基因,因此这些基因将会是本研究下一步继续深入研究CTD 抑制肝癌分子机制的研究对象。
[参考文献]
[1]El-Serag HB,Rudolph KL.Hepatocellular carcinoma:epidemiology and molecular carcinogenesis[J].Gastroenterology,2007,132(7):2557-2576.
[2]Fitzmaurice C,Allen C,Barber RM,et al.Global,regional,and national cancer incidence,mortality,years of life lost,years lived with disability,and disability-adjusted life-years for 32 cancer groups,1990 to 2015:a systematic analysis for the global burden of disease study[J].JAMA Oncol,2017,3(4):524-548.
[3]Jemal A,Ward EM,Johnson CJ,et al.Annual report to the nation on the status of cancer,1975-2014,featuring survival[J].J Natl Cancer Inst,2017,109(9):1-22.
[4]Singal AG,Pillai A,Tiro J,et al.Early detection,curative treatment,and survival rates for hepatocellular carcinoma surveillance in patients with cirrhosis:a meta-analysis[J].PLoS Med,2014,11(4):e1001624.
[5]国家药典委员会.中华人民共和国药典(一部)[M].北京:中国医药科技出版社,2015:331-332.
[6]王腾蛟,赵成坚,谷颖乐,等.HPLC 法测定绿芫菁中斑蝥素的含量[J].中国药房,2018,29(7):930-932.
[7]梅清华,励石寒,李华忠.斑蝥素超声波提取工艺研究[J].中国医院药学杂志,2005,25(3):46-50.
[8]高阳,于治国,毕开顺.斑蝥药材指纹图谱分析方法研究[J].中成药,2005,27(1):35-39.
[9]王贤英,杨琼芳,谢香菊.不同提取方法对斑蝥中斑蝥素含量测定的影响[J].中成药,2010,32(5):871-872.
[10]杨凤轩,钦忠,周建威.贵州短翅豆芫菁体内不同部位斑蝥素分布研究[J].江苏农业科学,2016,44(3):310-312.
[11]李晓飞,侯晓晖,陈祥盛.芫菁斑蝥素对喉癌细胞和胃癌细胞的抑制作用[J].昆虫学报,2009,52(9):946-951.
[12]Ren Y,Zhang SW,Xie ZH,et al.Cantharidin induces G2/M arrest and triggers apoptosis in renal cell carcinoma[J].Mol Med Rep,2016,14(6):5614-5618.
[13]Hsia TC,Yu CC,Hsiao YT,et al.Cantharidin impairs cell migration and invasionof human lung cancer NCI-H460 cells via UPA and MAPK signaling pathways[J].Anticancer Res,2016,36(11):5989-5997.
[14]Li CC,Yu FS,Fan MJ,et al.Anticancer effects of cantharidin in A431 human skin cancer (Epidermoid carcinoma) cells in vitro and in vivo[J].Environ Toxicol,2017,32(3):723-738.
[15]Wang Y,Kuramitsu Y,Kitagawa T,et al.Cofilin-phosphatase slingshot-1L (SSH1L) is over-expressed in pancreatic cancer (PC) and contributes to tumor cell migration[J].Cancer Lett,2015,360(2):171-176.
[16]Ramkissoon A,Chaney KE,Milewski D,et al.Targeted Inhibition of the Dual Specificity Phosphatases DUSP1 and DUSP6 Suppress MPNST Growth via JNK[J].Clin Cancer Res,2019,25(13):4117-4127.
[17]张秋强.长链非编码RNAFBXL19-AS1 在肝胞肝癌中的表达及其功能机制的研究[D].杭州:浙江大学,2020.
[18]贺珊,廖长秀,罗莹,等.走马胎活性组分对肝癌HepG2细胞DUSPs/MAPK 信号通路的影响[J].中成药,2021,43(2):344-349.
[19]Chen M,Zhang J,Berger AH,et al.Compound haploinsufficiency of Dok2 and Dusp4 promotes lung tumorigenesis[J].J Clin Invest,2019,129(1):215-222.
[20]Mansilla SF,de la Vega MB,Calzetta NL,et al.CDK-Independent and PCNA-Dependent Functions of p21 in DNA Replication[J].Genes,2020,11(6):593.
[21]Moser J,Miller I,Carter D,et al.Control of the Restriction Point by Rb and p21[J].Proc Natl Acad Sci U S A,2018,115(35):E8219-E8227.
[22]Malumbres M,Barbacid M.Cell cycle,CDKs and cancer:A changing paradigm[J].Nat Rev Cancer,2009,9(3):153-166.
Study on the mechanism of the active ingredients of Mongolian medicine Alagabanbu on HepG2 cells
MA Shi-qi1 DENG Xiu-ling2 WU Ya-nan2 HAN Jing-jing3 ZHAO Yang2 QIAO Yi-yun2 WANG Hai-sheng2▲
1. Departmen of Outpatient Office, Inner Mongolia Hospital of Traditional Chinese Medicine, Inner Mongolia Autonomous Region, Hohhot 010020, China; 2. Department of Biochemistry and Molecular Biology, School of Basic Medicine, Inner Mongolia Medical University, Inner Mongolia Autonomous Region, Hohhot 010110, China; 3. Department of Medical Experiment Center, School of Basic Medicine, Inner Mongolia Medical University, Inner Mongolia Autonomous Region, Hohhot 010110, China
1. Departmen of Outpatient Office, Inner Mongolia Hospital of Traditional Chinese Medicine, Inner Mongolia Autonomous Region, Hohhot 010020, China; 2. Department of Biochemistry and Molecular Biology, School of Basic Medicine, Inner Mongolia Medical University, Inner Mongolia Autonomous Region, Hohhot 010110, China; 3. Department of Medical Experiment Center, School of Basic Medicine, Inner Mongolia Medical University, Inner Mongolia Autonomous Region, Hohhot 010110, China
[Abstract] Objective To investigate the molecular mechanism of anticancer effect of cantharidin (CTD), the active ingredient of Mongolian medicine Alagabanbu on liver cancer. Methods CTD extracted by the research group was used to study the effect of CTD on the proliferation, apoptosis, cycle and other cell functions of HepG2 cells. Transcriptome sequencing was used to study the effect on mRNA gene expression of HepG2 cells. Results MTT results showed that the inhibition of HepG2 cell proliferation by CTD was dose-time dependent. Flow cytometry analysis results showed that cantharidin can induce cell cycle arrest in G2/M phase, and Caspase 3/7 fluorescence detection experiments confirmed that it can induce HepG2 cell apoptosis. Bioinformatics analysis after transcriptome sequencing, screened out 18 significantly differentially expressed mRNA genes. Conclusion CTD of Alagagambula extract can promote apoptosis and contact cell cycle arrest to inhibit hepatocellular carcinoma cells, and further affect the biological behavior of HepG2 by affecting the differential expression of mRNA genes, which may be a target for the early prediction and treatment of hepatocellular carcinoma.
[Key words] Alagabanbu; Cantharidin; Liver cancer; Tumor suppressor; mRNA
[中图分类号] R29
[文献标识码] A
[文章编号] 1674-4721(2021)12(a)-0009-04
[基金项目]内蒙古自治区科技创新引导项目(KCBJ2018021);内蒙古自治区自然科学基金项目(2020MS08132)。
[作者简介]马世琦(1986-),男,内蒙古呼和浩特人,硕士,研究方向:肿瘤免疫。
▲通讯作者:王海生,男,博士,教授,研究方向:肿瘤免疫。
(收稿日期:2021-05-20)