紫背天葵提取物对糖尿病小鼠血管炎症的影响
刘思妤 李 懿 谭 慧 黄 甜 张宇琴 谷 彬▲
湘南学院药理学教研室,湖南郴州 423000
[摘要] 目的 观察紫背天葵提取物对糖尿病小鼠血管炎症的影响。方法 选取2019 年6 月至8 月购得的60 只健康昆明小鼠作为研究对象,随机取6 只作为正常对照组,正常饮食,其余54 只小鼠均采用高糖高脂饲料喂养1 个月加小剂量链脲佐菌素(STZ)诱导法制备糖尿病小鼠模型,剔除未造模成功(血糖值<11.0 mmol/L)的小鼠,将剩下的造模成功小鼠分为糖尿病模型组、紫背天葵提取物不同剂量组、二甲双胍阳性对照组,每组6 只。 紫背天葵提取物组分别采用0.75、1.5、3 g/kg 灌胃,二甲双胍组采用150 mg/kg 灌胃,糖尿病模型组采用生理盐水灌胃。4 周后,比较各组小鼠的空腹血糖、体重、口服糖耐量。 收集小鼠血清,采用酶联免疫吸附测定(ELISA)法比较各组小鼠血清中炎症因子白介素-1β(IL-1β)、肿瘤坏死因子-α(TNF-α)、抗炎因子白介素-10(IL-10)的含量,采用实时荧光定量PCR 法比较小鼠胸主动脉IL-1β、TNF-α、IL-10 的表达。 结果 糖尿病模型组在实验结束时的血糖、口服糖耐量曲线下面积、血清IL-1β、TNF-α 含量及血管组织中IL-1β、TNF-α mRNA 表达均高于正常对照组,差异有统计学意义(P<0.05);糖尿病模型组小鼠的体重、血清IL-10 含量及血管组织中IL-10 mRNA 表达均低于正常对照组,差异有统计学意义(P<0.05)。1.5、3 g/kg 紫背天葵提取物组及二甲双胍组在实验结束后的血糖、血糖曲线下面积、血清IL-1β、TNF-α 含量及血管组织中IL-1β、TNF-α mRNA 表达均低于糖尿病模型组,差异有统计学意义(P<0.05);1.5、3 g/kg 紫背天葵提取物组及二甲双胍组小鼠的体重、血清IL-10 含量及血管组织中IL-10 mRNA表达高于糖尿病模型组,差异有统计学意义(P<0.05)。 结论 紫背天葵提取物可以抑制糖尿病小鼠血管炎症的产生。
[关键词]紫背天葵提取物;糖尿病小鼠;血管炎症;实时荧光定量PCR
糖尿病是由胰岛素分泌不足或抵抗引发的慢性代谢性疾病,而糖尿病血管病变是糖尿病患者死亡的主要原因[1]。已有研究表明,糖尿病的胰岛素抵抗及持续高糖状态可促进内皮细胞分泌多种炎症因子,最终会导致内皮功能障碍[2-4],而内皮功能障碍会加剧动脉粥样硬化的发生和发展[5]。因此,寻找控制高血糖所致炎症反应的药物能有效防治糖尿病血管损伤。紫背天葵又名天葵子,为秋海棠科秋海棠属植物,是药食同源的植物,有很高的保健开发价值[6]。近年来有研究表明,紫背天葵具有清热解毒、润燥、止咳化痰、凉血止血、消炎散瘀、消肿、降糖等生理活性[7],但是目前对紫背天葵抗糖尿病血管病变的研究相对较少。 基于此,本研究主要通过建立糖尿病小鼠模型,探讨紫背天葵提取物对糖尿病小鼠糖代谢、大血管损伤的影响及可能机制,探讨其对糖尿病小鼠血管的保护作用是否与抗炎有关。
1 对象与方法
1.1 实验动物
选取2019 年6 月至8 月购得的健康SPF 级雄性昆明小鼠[湖南斯莱克景达实验动物有限公司;合格证号:SCXK(湘)2019-0004]60 只,体重 15~18 g。 高脂高糖饲料配方为:10.0%猪油、20.0%蔗糖、2.5%胆固醇、1.0%胆酸纳、66.5%常规饲料[8]。
1.2 主要仪器与试剂
R-1001VN 旋转蒸发仪(郑州长城科工贸有限公司);EDC-810 基因扩增仪(东胜创新生物科技有限公司);QuantStudioTM3 Real-Time PCR 仪(美国 Thermo Fisher Scientific 公司);Legend Micro17R 冷冻高速离心机(美国 Thermo Fisher Scientific 公司);Cytation 1细胞成像微孔板检测仪(美国BioTek 公司);Centrifuge5810 R 冷冻高速离心机(美国Eppendorf 公司);二甲双胍(中美上海施贵宝制药有限公司);链脲佐菌素(streptozotocin,STZ,Sigma 公司) 临用前用枸橼酸-枸橼酸钠缓冲液(0.1 mol/L,pH 4.2)配置,5 min 内用完;白介素-1β(interleukin-1β,IL-1β)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、 白介素-10(interleukin-10,IL-10)酶联免疫吸附测定(enzyme-linked immunosorbent assay,ELISA)试剂盒(碧云天生物技术有限公司);胆酸钠、猪油、鼠饲料(湖南斯莱克景达实验动物有限公司);逆转录试剂盒、实时荧光定量PCR试剂盒(Fermentas 公司);TRIzol 试剂盒(Invitrogen 公司);IL-1β、IL-10、TNF-α 引物(上海生工生物工程有限公司)。
1.3 方法
1.3.1 紫背天葵水提物的制备 紫背天葵药材购于老百姓大药房,经湘南学院药学院药用植物教研室鉴定为菫菜目秋海棠科秋海棠属。取紫背天葵400 g,粉碎,水提,10 倍体积的水浸泡30 min,微沸回流提取2 h,收集滤液,滤渣再加8 倍量水,微沸回流提取2 h,收集滤液。提取液进行200 目纱滤,合并两次滤液,采用旋转蒸发仪进行减压浓缩, 浓缩温度均在60℃左右,浓缩至适量, 得浸膏, 收膏量为46 g, 得率为11%,80℃以下真空干燥。
1.3.2 糖尿病小鼠模型的制备及分组 取健康SPF 级昆明种雄性小鼠60 只分笼饲养于动物室内, 室温20~25℃,明暗各12 h。适应性喂养一周后,随机取6只作为正常对照组,饲喂基础饲料,其余54 只饲喂高脂饲料,4 周后除正常对照组外, 其余各组均禁食不禁水 12 h,连续3 d 腹腔注射 STZ 30 mg/kg,进一步增强小鼠的代谢紊乱, 继续给予高脂饲料1 周,1 周后禁食16 h,测定空腹血糖,血糖值>11.0 mmol/L 为造模成功小鼠,剔除未造模成功的小鼠,将剩下的30 只造模成功小鼠分为糖尿病模型组、紫背天葵提取物不同剂量组、二甲双胍阳性对照组,每组6 只,继续喂养高脂饲料。紫背天葵提取物组采用0.75、1.5、3 g/kg 灌胃,二甲双胍组采用150 mg/kg 灌胃,糖尿病模型组采用生理盐水灌胃,灌胃4 周后检测相关指标。
1.4 观察指标及检测方法
1.4.1 测定小鼠体重、空腹血糖、葡萄糖耐量 末次给药后禁食不禁水12 h,称量小鼠体重,尾尖取血,用血糖仪测定空腹血糖值, 然后各组灌胃葡萄糖2 g/kg,在 0、0.5、1、1.5、2 h 时分别从尾部取血检测血糖值,采用口服葡萄糖耐量 (oral glucose tolerance test,OGTT)试验检测糖尿病模型小鼠的血糖曲线下面积。1.4.2 血清中炎症因子含量测定 摘眼球取血, 血液4℃静置 30 min,12 000 r/min 离心 20 min,吸出上清液即为血清, 采用ELISA 法测定血清中 IL-1β、IL-10、TNF-α 的含量。
1.4.3 实时荧光定量 PCR 法检测 IL-1β、IL-10、TNF-α mRNA 的表达 提取小鼠的胸主动脉组织总RNA,逆转录试剂盒制备cDNA,随后进行PCR 扩增。引物序列如下。 (IL-1β)F:5′-CAGGATGAGGACAT GAGCAC-3′,R:5′-CAGTTGTCTAATGGGAACGTCA-3′;(IL-10)F:5′-GCTCTTACTGACTGGCATGA-3′,R:5′-CGCAGCTCTAGGAGCATGTG-3′;(TNF-α)F:5′-ACGTGGAACTGGCAGAAGAG-3′,R:5′-CTCCTCCAC TTGGTGGTTTG-3′;(β-actin)F:5′-AGAGGGAAATC GTGCGTGAC-3′,R:5′-CAATAGTGATGACCTGGCCGT-3′。引物由上海生工生物工程公司合成。反应条件:94℃ 10 s,95℃ 5 s,60℃ 31 s,共 40 个循环。 运用comparative 2-△△CT 法分析基因的相对表达。
1.5 统计学方法
采用SPSS 17.0 统计学软件进行数据分析, 计量资料用均数±标准差(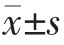 )表示,多组间比较采用单因素方差分析(One-Way ANOVA),两组间比较采用t检验,以P<0.05 为差异有统计学意义。
)表示,多组间比较采用单因素方差分析(One-Way ANOVA),两组间比较采用t检验,以P<0.05 为差异有统计学意义。
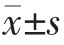 )表示,多组间比较采用单因素方差分析(One-Way ANOVA),两组间比较采用t检验,以P<0.05 为差异有统计学意义。
)表示,多组间比较采用单因素方差分析(One-Way ANOVA),两组间比较采用t检验,以P<0.05 为差异有统计学意义。2 结果
2.1 紫背天葵提取物对糖尿病小鼠体重的影响
糖尿病模型组小鼠的体重低于正常对照组,差异有统计学意义(P<0.01);0.75 g/kg 紫背天葵提取物组小鼠的体重与糖尿病模型组比较,差异无统计学意义(P>0.05);1.5、3 g/kg 紫背天葵提取物组及二甲双胍组的小鼠体重高于糖尿病模型组,差异有统计学意义(P<0.05)(图 1)。
.jpg)
图1 紫背天葵提取物对糖尿病小鼠体重的影响
2.2 紫背天葵提取物对糖尿病小鼠空腹血糖及血糖曲线下面积的影响
糖尿病模型组小鼠的空腹血糖高于正常对照组,差异有统计学意义(P<0.01);1.5、3 g/kg 紫背天葵提取物组及二甲双胍组小鼠的血糖低于糖尿病模型组,差异有统计学意义(P<0.05)。 糖尿病模型组小鼠的血糖下面积高于正常对照组,差异有统计学意义(P<0.01);1.5、3 g/kg 紫背天葵提取物组及二甲双胍组小鼠的血糖下面积低于糖尿病模型组,差异有统计学意义(P<0.05)(图 2)。
.jpg)
图2 紫背天葵提取物对糖尿病小鼠空腹血糖及血糖曲线下面积的影响
2.3 紫背天葵提取物对糖尿病小鼠血清炎症因子的影响
糖尿病模型组小鼠的IL-1β、TNF-α 含量高于正常对照组,IL-10 含量低于正常对照组, 差异有统计学意义(P<0.01);二甲双胍组及 0.75、1.5、3 g/kg 紫背天葵提取物组的IL-1β 含量低于糖尿病模型组,差异有统计学意义(P<0.05);二甲双胍组及 1.5、3 g/kg 紫背天葵提取物组的TNF-α 含量低于糖尿病模型组,IL-10 含量高于糖尿病模型组, 差异有统计学意义(P<0.05)(图 3)。
.jpg)
图3 紫背天葵提取物对糖尿病小鼠血清炎症因子含量的影响
2.4 紫背天葵提取物对糖尿病小鼠胸主动脉炎症因子mRNA 表达的影响
糖尿病模型组小鼠的胸主动脉IL-1β、TNF-α mRNA 表达高于正常对照组,IL-10 mRNA 表达低于正常对照组,差异有统计学意义(P<0.01);1.5、3 g/kg紫背天葵提取物组及二甲双胍组小鼠的胸主动脉IL-1β、TNF-α mRNA 表达低于糖尿病模型组,IL-10 mRNA 表达高于糖尿病模型组, 差异有统计学意义(P<0.05)(图 4)。
.jpg)
图4 紫背天葵提取物对糖尿病小鼠胸主动脉炎症因子mRNA 表达的影响
3 讨论
大血管病变是糖尿病慢性并发症中致死、致残的重要因素之一,而糖尿病所致的慢性炎症反应则是该并发症的主要原因之一[9]。有研究表明,糖尿病及血管病变是一种慢性炎症性疾病[10-11],血液中炎症因子水平升高以及抑炎因子水平下降可引起血管内皮功能障碍、血管炎症反应的增加,促进糖尿病血管病变的发生和发展[12-13],而抑制炎症反应能有效延缓疾病进程[14]。 目前,应用有效药物能延缓和控制糖尿病引起的慢性炎症性血管并发症, 但是这是一个长期的过程,且毒副作用强。 天然的降糖抑炎物质具有毒副作用小、安全有效、患者依从性更好的优点,以此作为糖尿病慢性炎症血管病变的治疗具有很好的应用价值。
紫背天葵是药食同源的药用植物,富含铁、维生素A、维生素C、胡萝卜素、钙等多种微量元素,具有清热解毒、散瘀消肿、活血止血、润肺止咳、提高人体免疫力等功效[15]。 有研究报道,紫背天葵中含有黄酮类成分,能降低糖尿病大鼠的血糖[16]。 本研究也证实,紫背天葵水提物能有效地降低糖尿病小鼠的血糖,并且能改善糖尿病小鼠的葡萄糖耐量,改善机体对血糖浓度的调节能力,说明紫背天葵提取物对糖尿病小鼠的糖代谢紊乱起到了一定程度的改善作用。糖尿病发展末期,体重显著下降,机体免疫力下降,本研究结果显示, 紫背天葵提取物能显著提高糖尿病小鼠的体重,增强糖尿病小鼠的体质。
糖尿病血管病变是一种慢性炎症性疾病,炎症反应参与了血管病变的整个过程。血清炎症因子水平升高可引起血管内皮功能障碍、凋亡增加,促进血管病变的发生和发展[17-19]。本研究结果显示,紫背天葵提取物能降低糖尿病小鼠血清中炎症因子IL-1β、TNF-α的水平, 同时降低胸主动脉IL-1β、TNF-α 炎症因子转录水平。 IL-10 被称为“细胞因子合成抑制因子”,具有一定抗炎效应[20]。 本研究结果显示,紫背天葵提取物能在一定程度增加糖尿病小鼠血中IL-10 的含量及胸主动脉IL-10 的表达,从另一方面证实紫背天葵提取物具有抗炎作用。
综上所述,紫背天葵提取物能有效降低糖尿病小鼠的血糖, 改善糖尿病小鼠对血糖浓度的调节能力,增强糖尿病小鼠的体重并能改善糖尿病小鼠血管并发症,其机制可能与抑制其炎症反应有关,为药食同源植物紫背天葵的开发和利用提供理论依据。
[参考文献]
[1]Ahlqvist E,Prasad RB,Groop L.Subtypes of Type 2 Diabetes Determined From Clinical Parameters[J].Diabetes,2020,69(10):2086-2093.
[2]Wooff Y,Man SM,Aggio-Bruce R,et al.IL-1 Family Members Mediate Cell Death,Inflammation and Angiogenesis in Retinal Degenerative Diseases[J].Front Immunol,2019,10:1618.
[3]杨炀,占敏霞,杜伟,等.糖尿病大血管病变内皮功能障碍的作用机制及现代中药的研究进展[J].中药药理与临床,2018,34(5):177-181.
[4]封芬,谭安雄,邓集湘,等.黄连素对2 型糖尿病大鼠大血管病变PI3K/Akt 信号通路的影响[J].邵阳学院学报(自然科学版),2018,15(4):110-116.
[5]Katakami N.Mechanism of Development of Atherosclerosis and Cardiovascular Disease in Diabetes Mellitus[J].J Atheroscler Thromb,2018,25(1):27-39.
[6]施衡乐,郜海燕,韩延超,等.紫背天葵茶饮料的研制[J].食品工业科技,2019,40(7):166-171.
[7]张文展,刘定荣,马金莲,等.紫背天葵的研究进展及其在航天食品上的应用[J].食品工业,2019,40(4):260-262.
[8]Liu SY,Yuan Q,Li XH,et al.Role of vascular peroxidase 1 in senescence of endothelial cells in diabetes rats[J].Int J Cardiol,2015,197:182-191.
[9]Eksi MS,Kara M,Ozcan-Eksi EE,et al.Is diabetes mellitus a risk factor for modic changes?:A novel model to understand the association between intervertebral disc degeneration and end-plate changes[J].J Orthop Sci,2020,25(4):571-575.
[10]尤良震,于东东,黄万秋,等.基于microRNAs 与炎症因子相关性探讨丹蛭降糖胶囊对GK 大鼠糖尿病大血管病变治疗作用机制[J].中国中药杂志,2019,44(20):4519-4528.
[11]Hahad O,Wild PS,Prochaska JH,et al.Endothelial Function Assessed by Digital Volume Plethysmography Predicts the Development and Progression of Type 2 Diabetes Mellitus[J].J Am Heart Assoc 2019,8(20):e012509.
[12]Srivastava P,Badhwar S,Chandran DS,et al.Imbalance between Angiotensin Ⅱ-Angiotensin (1-7) system is associated with vascular endothelial dysfunction and inflammation in type 2 diabetes with newly diagnosed hypertension[J].Diabetes Metab Syndr,2019,13(3):2061-2068.
[13]Cecilia C,Wang L,Connie N,et al.Atherosclerotic Cardiovascular Disease and Heart Failure in Type 2 Diabetes-Mechanisms,Management,and Clinical Considerations[J].Circulation,2016,133(24):2459-2502.
[14]Spencer BG,Estevez JJ,Liu E,et al.Pericytes,inflammation,and diabetic retinopathy[J].Inflammopharmacology,2020,28(3):697-709.
[15]郑子新,唐晓伟,薛长勇,等.紫背天葵乙醇提取物对健康小鼠血糖的调节效应[J].中国组织工程研究与临床康复,2007,11(47):9503-9507.
[16]王红珊,吴琳,曹毅敏,等.紫背天葵提取物对糖尿病模型大鼠的降血糖作用研究[J].中国药房,2013,24(11):985-986.
[17]Hu R,Wang MQ,Ni SH,et al.Salidroside ameliorates endothelial inflammation and oxidative stress by regulating the AMPK/NF-kappaB/NLRP3 signaling pathway in AGEsinduced HUVECs[J].Eur J Pharmacol,2020,867:172797.
[18]Jha JC,Ho F,Dan C,et al.A causal link between oxidative stress and inflammation in cardiovascular and renal complications of diabetes[J].Clin Sci (Lond),2018,132(16):1811-1836.
[19]Koh SS,Ooi SC,Lui NM,Qiong C,et al.Effect of Ergothioneine on 7-Ketocholesterol-Induced Endothelial Injury[J].Neuromolecular Med,2021,23(1):184-198.
[20]Saiki P,Kawano Y,Nakajima Y,et al.Novel and Stable Dual-Color IL-6 and IL-10 Reporters Derived from RAW 264.7 for Anti-Inflammation Screening of Natural Products[J].Int J Mol Sci,2019,20(18):4620.
Effect of extract of Begonia Fimbristipula on the vascular inflammation of diabetic mices
LIU Si-yu LI Yi TAN Hui HUANG Tian ZHANG Yu-qin GU Bin▲
Department of Pharmacology, Xiangnan University, Hu′nan Province, Chenzhou 423000, China
Department of Pharmacology, Xiangnan University, Hu′nan Province, Chenzhou 423000, China
[Abstract] Objective To observe the effect of extract of Begonia Fimbristipula on the vascular inflammation of diabetic mices. Methods A total of 60 healthy Kunming mice from June to August in 2019 were selected as the research objects. Six mice were randomly selected as normal control group and fed with normal diet. The other 54 mice were fed with high sugar and high fat diet for one month and induced by low-dose streptozotocin (STZ). Mice without successful modeling (blood glucose <11.0 mmol/L) were excluded, and the remaining successful modeling mice were divided into diabetic model group, different doses of Begonia Fimbristipula extract group and Metformin-positive control group, with 6 mice in each group. The extract group was given 0.75, 1.5 and 3 g/kg intragastric administration, the Metformin group was given 150 mg/kg intragastric administration, and the diabetic model group was given normal saline intragastric administration. After 4 weeks, fasting blood glucose, body weight and oral glucose tolerance were compared. The contents of interleukin-1β (IL-1β), tumor necrosis factor-α (TNF-α) and interleukin-10 (IL-10) in serum of mice in each group were compared by enzyme-linked immunosorbent assay (ELISA). The expressions of IL-1β, TNF-α and IL-10 in thoracic aorta of mice were compared by real-time fluorescence quantitative PCR. Results At the end of the experiment, blood glucose, area under oral glucose tolerance curve, contents of IL-1β and TNF-α in serum and mRNA expression of IL-1β and TNF-α in vascular tissue in diabetic model group were higher than those in normal control group, and the differences were statistically significant (P<0.05). The body weight, serum IL-10 content and IL-10 mRNA expression in vascular tissues of dia-betic model group were lower than those of normal control group, and the differences were statistically significant (P<0.05). After the experiment, blood glucose, area under blood glucose curve, contents of IL-1β and TNF-α in serum and mRNA expression of IL-1β and TNF-α in vascular tissue in 1.5 and 3 g/kg Begonia Fimbristipula extract group and Metformin group were lower than those in diabetic model group, and the differences were statistically significant (P<0.05). The body weight, serum IL-10 content and IL-10 mRNA expression in blood vessels of mice in 1.5 and 3 g/kg Begonia Fimbristipula extract group and Metformin group were higher than those in diabetic model group, and the differences were statistically significant (P<0.05). Conclusion Extract of Begonia Fimbristipula can inhibit the production of vascular inflammation in diabetic mices.
[Key words] Extract of Begonia Fimbristipula; Diabetic mice; Vascular inflammation; Real-time fluorescence quantitative PCR
[中图分类号] R285.5
[文献标识码] A
[文章编号] 1674-4721(2021)12(a)-0004-05
[基金项目]国家级大学生创新创业训练计划项目(S2019105 45011);湖南省自然科学基金青年项目(2018JJ3480);湖南省教育厅科学研究优秀青年项目(18B498)。
[作者简介]刘思妤(1981-),女,湖南郴州人,硕士,副教授,主要从事中药药理学研究。
▲通讯作者:谷彬(1980-),男,湖南郴州人,硕士,副教授,主要从事心血管药理学研究。
(收稿日期:2021-04-25)