不同性别平衡易位携带者胚胎植入前遗传学检测相关遗传学分析
何 萍 李哲涛 王文丹 韦朔峰 严提珍▲
广西壮族自治区柳州市妇幼保健院医学遗传科(柳州市生殖医学重点实验室),广西柳州 545001
[摘要]目的 探讨不同性别平衡易位携带者胚胎植入前遗传学检测(PGT)染色体组构成情况及不同亲本来源对子代染色体形成的影响。方法 选取柳州市妇幼保健院2017年1月至2021年6月行外周血染色体检查的不孕不育夫妇进行核型分析,筛选出平衡易位携带者,并对平衡易位携带者夫妇实施辅助生殖技术,对囊胚期胚胎采用高通量测序技术进行PGT,对不同性别的染色体平衡易位携带者囊胚期胚胎染色体组类型和构成情况进行分析比较。结果 通过染色体核型分析,共筛选出113对双方之一为染色体平衡易位携带者夫妇,女性携带者42例,男性携带者71例。应用高通量测序行胚胎植入前染色体结构变异检测(PGT-SR),共检测738个囊胚期胚胎,获得可移植胚胎168个,其中来自男性携带者的126个,来自女性携带者的42个。男性相互平衡携带者获得可移植胚胎率、单纯不平衡胚胎率、散发性异常胚胎率、复杂性异常胚胎率分别为27.8%、19.6%、41.6%、38.8%;女性相互平衡携带者获得可移植胚胎率、单纯不平衡胚胎率、散发性异常胚胎率、复杂性异常胚胎率分别为15.5%、25.9%、32.9%、41.2%。不同亲本来源的可移植胚胎率比较,差异有统计学意义(父源27.8%,母源15.5%,χ2=15.253,P<0.05);单纯不平衡胚胎率比较,差异无统计学意义(父源19.6%,母源25.9%,χ2=3.096,P>0.05);不同亲本来源的散发性异常胚胎率比较,差异有统计学意义(父源41.6%,母源32.9%,2=4.310,P<0.05);不同亲本来源的复杂性异常胚胎率比较,差异无统计学意义(父源38.8%,母源41.2%,χ2=0.320,P>0.05)。结论 女性相互平衡易位携带者获得可移植胚胎率和散发性异常胚胎率显著低于男性携带者,单纯不平衡胚胎率及复杂性异常胚胎率均高于男性携带者。
[关键词]染色体核型;平衡易位携带;胚胎植入前遗传学检测;高通量测序
染色体是承载遗传信息的特有物质。人类体细胞的染色体数目为23对,包括22对常染色体和1对性染色体,并有特定的形态和结构。一旦染色体数目或形态结构发生改变,称为染色体异常。而染色体异常是导致不育、复发性流产、胚胎停育、畸胎、死胎、出生缺陷等发生的主要原因。而染色体平衡易位是染色体结构异常中发生率极高的一大类。染色体平衡易位携带者,指的是无遗传物质丢失的染色体结构异常,且无临床表型者,其发生率为1/500[1]。染色体平衡易位携带者,虽然其表型正常,但是在其生育过程中,由于染色体重组时可产生高比例的非平衡配子,而极易导致不育、复发性流产、胚胎停育、畸胎、死胎、出生缺陷等不良生育史的发生[2]。根据生殖细胞减数分裂机理,理论上,常染色体相互平衡易位携带者可有18种配子产生,罗氏易位可有6种配子产生,但由于易位发生的染色体组别、片段大小、位置及易位发生片段所携带功能基因以及携带者性别等不同,临床上其能形成成熟配子、胚胎及生长至不同发育阶段胚胎临床上有很大差异。
胚胎植入前遗传学检测(preimplantation genetic testing,PGT)是辅助生殖技术与遗传学检测技术相结合的,近年迅速发展起来的新型孕前诊断技术,通过体外受精(in vitro fertilization,IVF)或者卵胞浆内单精子注射(intracytoplasmic sperm injection,ICSI)在胚胎植入宫腔前,对胚胎或者对卵裂球或极体行活检,通过染色体核型分析和基因检测而获得无疾病表型的优质胚胎的辅助生殖技术。针对染色体平衡易位携带者,PGT的出现,可以阻止复发性流产、胚胎停育、畸胎、死胎、出生缺陷等的发生成为可能。
1 资料与方法
1.1 一般资料
选取柳州市妇幼保健院2017年1月至2021年6月行外周血染色体检查的不孕不育夫妇进行核型分析,筛选出平衡易位携带者,并对平衡易位携带者夫妇实施辅助生殖技术,对囊胚期胚胎采用高通量测序技术进行PGT。
1.2 方法
1.2.1 外周血染色体核型分析 受检者签署知情同意书后采集外周血2 ml进行常规染色体培养、制片后,进行染色体G显带核型分析,筛选染色体平衡易位携带者。
1.2.2 体外受精培养及胚胎活检 根据卵巢功能选择合适的促排方案,于取卵后4 h行ICSI,授精后16~18 h检测受精情况,胚胎培养至第3天评估胚胎生长情况。正常授精后第3天卵裂球≥6个,碎片<20%,卵裂均匀者视为优质胚胎。于第5天或者第6天囊胚期进行胚胎活检,并取出适量滋养外胚层细胞用于后续检测。
1.2.3 胚胎植入前遗传学检测 活检细胞样本转移至聚合酶链式反应(polymerase chain reaction,PCR)管,采用植入前胚胎染色体非整倍体检测试剂盒(贝瑞和康)进行全基因组扩增,扩增后进行文库构建和纯化,然后通过Next Seq CN500测序平台(Illumina公司)对扩增产物进行测序,通过科孕安数据分析系统(贝瑞和康)对测序原始数据进行生物信息学分析,并参考人类基因组hg19版本出具胚胎植入前染色体结构变异检测(preimplantation genetic testing for structural rearrangements,PGT-SR)报告。质控要求:DNA 浓度≥10 ng/μL,原始数据过滤后 reads≥2.7 M,Q30 的碱基百分比≥80%,分析标准为Uniq reads≥1.5 M,对染色体进行整倍体、微缺失及微重复的判读,判读范围:23对染色体非整倍体、4 Mb及以上片段的缺失/重复、30%及以上的嵌合。
1.3 观察指标
通过高通量测序进行PGT,获得不同性别的平衡易位携带者囊胚期胚胎染色体组类型和构成情况,包括可移植胚胎(正常/平衡易位携带胚胎)、单纯不平衡胚胎(亲代染色体易位导致染色体重排引起的染色体非整倍体或者拷贝数变异)、散发性异常胚胎(非亲代染色体易位相关的染色体非整倍体或拷贝数变异)、复杂性异常胚胎(同时包括前面两种异常情况)。
1.4 统计学方法
采用SPSS 19.0统计学软件进行数据分析,计数资料采用率(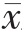 ±s)表示,组间比较采用 χ2检验,以 P<0.05为差异有统计学意义。
±s)表示,组间比较采用 χ2检验,以 P<0.05为差异有统计学意义。
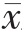 ±s)表示,组间比较采用 χ2检验,以 P<0.05为差异有统计学意义。
±s)表示,组间比较采用 χ2检验,以 P<0.05为差异有统计学意义。2 结果
2.1 染色体平衡易位携带者外周血染色体核型分析
通过染色体核型分析,共筛选出113对其中一方为染色体平衡易位携带者的夫妇,女性携带者42例,男性携带者71例(表1)。
表1 染色体平衡易位携带者外周血染色体核型分析
.jpg)
2.2 染色体平衡易位携带者囊胚期胚胎高通量测序结果分析
应用高通量测序行PGT-SR检测,共检测738个囊胚期胚胎,来自男性携带者461个,女性携带者277个,检测失败15个(来自男性携带者8个,女性携带者7个)。获得可移植胚胎168个,其中来自男性携带者的126个,来自女性携带者的42个。男性相互平衡携带者获得可移植胚胎率、单纯不平衡胚胎率、散发性异常胚胎率、复杂性异常胚胎率分别为27.8% (126/453)、19.6% (64/327)、41.6% (136/327)、38.8%(127/327);女性相互平衡携带者获得可移植胚胎率、单纯不平衡胚胎率、散发性异常胚胎率、复杂性异常胚胎率分别为15.5%(42/270)、25.9%(59/228)、32.9%(75/228)、41.2%(94/228)。不同亲本来源的可移植胚胎率比较,差异有统计学意义(父源27.8%,母源 15.5%,χ2=15.253,P<0.05),单纯不平衡胚胎率比较,差异无统计学意义(父源19.5%,母源25.9%,χ2=3.096,P>0.05),不同亲本来源的散发性异常胚胎率比较,差异有统计学意义(父源41.6%,母源32.9%,χ2=4.310,P<0.05),不同亲本来源的复杂性异常胚胎率比较,差异无统计学意义(父源38.9%,母源41.2%,χ2=0.320,P>0.05)(表 2)。
表2 染色体平衡易位携带者囊胚期胚胎高通量测序结果分析[%(n/N)]
.jpg)
3 讨论
染色体结构发生异常改变是导致不育、复发性流产、胚胎停育、畸胎、死胎、出生缺陷等发生的主要遗传学病因。PGT作为新型的孕前诊断技术,针对染色体平衡易位携带者,在胚胎植入前筛选非整倍体异常胚胎,获得正常或平衡易位携带优质胚胎,从而显著减少不育、复发性流产、胚胎停育、畸胎、死胎、出生缺陷等的发生。
另外,PGT的取材主要来源于卵母细胞极体、卵裂球及囊胚滋养外胚层。卵裂球是临床上应用最广的PGT活检来源[3]。许多来咨询PGT的平衡易位携带夫妇,既希望通过PGT获得正常或平衡易位携带优质胚胎,又担心活检会对胚胎本身造成不利影响。国内外多项研究表明在胚胎发育至第3天移走1~2个细胞并不影响胚胎的后续发育[4],但是活检的材料少,卵裂期胚胎存在高嵌合率[5],为35%~40%,影响PGT的准确性。囊胚滋养外胚层可以活检2~10个细胞,相较于卵母细胞极体、卵裂球单细胞活检,其能提供更多的材料,提高了PGT的准确性,且不涉及发育成胎儿部分的内细胞团,从而避免了活检对胚胎所造成的不利影响[6]。另外,囊胚期胚胎嵌合体发生率较低,许多研究表明囊胚期活检优于卵裂期活检[7]。
理论上,根据生殖细胞减数分裂原理,常染色体相互平衡易位携带者可以产生18种配子,1/18概率染色体完全正常,1/18概率染色体平衡易位携带而临床表型无明显异常,其余16/18均为部分单体或者三体不平衡异常配子,后者临床表现通常为不育、流产、畸胎、死胎、及出生缺陷等。换句话说,理论上常染色体平衡易位携带者可有2/18(11%)概率获得正常子代可能,不同亲本来源对正常子代获得率没有影响。有些研究认为,不同亲本来源获得的实际可移植胚胎率(正常子代获得率)可能与理论值不一致,染色体相互易位的遗传风险与相互易位携带者性别相关,不同性别的携带者获得可移植胚胎比例可能存在差异[8-9]。本研究结果显示,男性相互平衡易位携带者获得可移植胚胎率为27.8%(>11%),女性相互平衡易位携带者获得可移植胚胎率为15.5%(>11%),不同性别的携带者获得可移植胚胎比例均高于理论值。
有些研究认为,不同亲本来源的正常子代获得率与理论概率是存在差异性的,Zhang等[10]研究相互易位亲本来源对子代减数分裂染色体分离方式发现,男性相互易位携带者正常平衡胚胎率为42.71%,女性携带者为38.85%;Idowu等[11]研究发现男性平衡易位携带者获得整倍体胚胎比例为25%,女性平衡易位携带者为26%。在本研究中,男性相互平衡易位携带者获得可移植胚胎率为27.8%(126例),女性相互平衡易位携带者获得可移植胚胎率为15.5%(42例),不同亲本来源的获得可移植胚胎率比较,差异有统计学意义(P<0.05),男性携带者获得可移植胚胎率明显高于女性携带者,具有统计学意义,与Mateu-Brull等[12-13]研究相符,但与Zhang等[10]的研究结果不一致。通过分析比较发现,上述研究结果的非一致性主要源于研究对象选择及研究方法的差异,Zhang等[10]将平衡易位作为整体研究对象,忽略了相互平衡易位与罗氏易位遗传风险的背景差异,而Idowu等[11]研究方法主要采用SNP array技术,有研究表明NGS能发现更多拷贝数变异和低比例的嵌合体[14],本研究应用了NGS技术,但是没有详细罗列出相互平衡易位与罗氏易位的结果比较。
理论上,针对常染色体相互平衡易位携带者,其产生的部分单体或者部分三体一般源于发生相互易位的染色体。早期胚胎植入前遗传学诊断主要采用荧光原位杂交技术检测亲本相互易位的染色体是否异常[15-16]。然而近些年进展性研究发现,配子异常不仅仅局限于出现相互易位的染色体,其他染色体也会发生散发性染色体非整倍体变异或拷贝数变异,或者同时包括相互易位的染色体和其他染色体。随着NGS技术在染色体平衡易位携带者植入前遗传学检测应用逐步广泛,以其高分辨率、高通量、一次性检测更多CNV、准确性高、费用少、诊断迅速,将成为PGT强有力的检测手段[17-19]。本研究结果显示,男性相互平衡易位携带者单纯不平衡胚胎率为19.6%(64例),女性相互平衡易位携带者为25.9%(59例),不同亲本来源的单纯不平衡胚胎率比较,差异无统计学意义(P>0.05),女性相互平衡易位携带者单纯不平衡胚胎率略高于男性携带者,但不具有统计学意义;男性相互平衡易位携带者散发性异常胚胎率为41.6%(136例),女性相互平衡易位携带者为33.9%(75例),不同亲本来源的散发性异常胚胎率比较,差异有统计学意义(P<0.05),男性相互平衡易位携带者散发性异常胚胎率明显高于女性携带者,具有统计学意义;男性相互平衡易位携带者复杂性异常胚胎率为38.8%(127例),女性相互平衡易位携带者为41.2%(94例),不同亲本来源的复杂性不平衡胚胎率比较,差异无统计学意义(P>0.05)。
综上所述,本研究比较分析不同性别的染色体相互平衡易位携带者囊胚期胚胎染色体构成情况及影响,结果表明,女性相互平衡易位携带者获得可移植胚胎比例低于男性携带者,单纯不平衡胚胎及复杂性异常胚胎比例比较,差异无统计学意义(P>0.05),可能与研究数据相对有限相关,而散发性异常胚胎比例为男性相互平衡易位携带者明显高于女性携带者,差异有统计学意义(P<0.05)。因此,染色体相互平衡易位携带行PGT时,遗传咨询应考虑亲本来源对子代胚胎产生的不同影响并告知患者知情。值得一提的是,不同亲本来源获得可移植胚胎比例均高于理论值,及不同性别相互平衡易位携带者均存在6%~30%未获得可移植胚胎的可能[20],也在PGT遗传咨询时充分考虑到并告知患者知情。本研究能够为临床提供较为客观精确的遗传咨询指导意见,但由于本研究的研究对象有限,仍需更大的样本数进行更精确的相关研究。
[参考文献]
[1]刘茜桐,田莉,师娟子.胚胎植入前遗传学诊断和筛查研究进展[J].中国妇女健康研究,2016,27(1):123-125.
[2]Liao YP,Wang CJ,Liang M,et al.Analysis of genetic characteristics and reproductive risks of balanced complex chromosome rearrangement carriers in China[J].Yi Chuan,2017,39(5):396-412.
[3]Alfarawati S,Fragouli E,Colls P,et al.First births after preimplantation genetic diagnosis of structural chromosome abnormalities using comparative genomic hybridization and microarray analysis[J].Hum Reprod,2011,26(6):1560-1574.
[4]ESHRE PGD Consortium Stering Committee.ESHRE Preimplantation Genetic Diagnosis Consortium:data collection Ⅲ(May 2001)[J].Hum Reprod,2002,17(1):233-246.
[5]Brezina PR,Brezina DS,Kearns WG.Preimplantation genetic testing[J].BMJ,2012,345:e5908.
[6]Mastenbroek S,Twisk M,van der Veen F,et al.Preimplantation genetic screening:a systematic review and meta-analysis of RCTs[J].Hum Reprod Update,2011,17(4):454-466.
[7]Ko DS,Cho JW,Park SY,et al.Clinical outcomes of preimplantation genetic diagnosis (PGD)and analysis of meiotic segregation modes in reciprocal translocation carriers[J].Am J Med Genet A,2010,152A(6):1428-1433.
[8]Iwarsson E,Malmgren H,Inzunza J,et al.Highly abnormal cleavage divisions in preimplantation embryos from translocation carriers[J].Prenat Diagn,2000,20(13):1038-1047.
[9]Forman EJ,Tao X,Ferry KM,et al.Single embryo transfer with comprehensive chromosome screening results in improved ongoing pregnancy rates and decreased miscarriage rates[J].Hum Reprod,2012,27(4):1217-1222.
[10]Zhang S,Lei C.Analysis of segregation patterns ofquadrivalent structures and the effect on genome stability during meiosis in reciprocal translocation carriers[J].Hum Reprod,2018,33(4):757-767.
[11]Idowu D,Merrion K.Pregnancy outcomes following 24-chromosome preimplantation genetic diagnosis in couples with balanced reciprocal or Robertsonian translocations[J].Fertil Steril,2015,103(4):1037-1042.
[12]Mateu-Brull,E Rodrigo,L Peinado,et al.Interchromosomal effect in carriers of translocations and inversions assessed by preimplantation genetic testing for structural rearrangements(PGT-SR)[J].J Assist Reprod Genet,2019,36(12):2547-2555.
[13]孙庆云,杜元杰,王跃,等.染色体结构异常PGT周期中囊胚评估参数与其整倍体率的相关性[J].生殖医学杂志,2021,30(3):304-312.
[14]Xu J.Comparative study of single-nucleotide polymorphism array and next generation sequencing based strategies on triploid identification in preimplantation genetic diagnosis and screen[J].Oncotarget,2016,7(49):81839-81848.
[15]李刚,孙莹璞,金海霞,等.胚胎染色体非整倍体筛查用于平衡易位携带者植入前的遗传学诊断[J].中华妇产科杂志,2011,46(1):32-35.
[16]钱羽力,徐晟明,金帆,等.染色体易位的植入前遗传学诊断[J].中华妇产科杂志,2008,43(8):581-583.
[17]范俊梅,李娜、刘忠宇,等.应用基因组杂交、单核苷酸芯片及二代技术开展植入前染色体异常诊断[J].中国实用妇科与产科杂志,2014,30(7):565-570.
[18]张雯珂,徐晓菲.染色体易位携带者胚胎植入前遗传学诊断进展[J].国际生殖健康/计划生育杂志,2015,34(4):325-327.
[19]张静,吕睿,吕永焕,等.胚胎植入前遗传学诊断和筛查研究进展[J].国际生殖健康/计划生育杂志,2015,34(3):243-247.
[20]肖卓妮,周方元,韩瑞玲,等.基于二代测序技术比较父源与母源性染色体相互易位携带者子代染色体差异[J].中国优生与遗传杂志,2019,27(5):604-607.
Related genetic analysis for preimplantation genetic testing in carriers of balanced translocations with different genders
HE Ping LI Zhe-tao WANG Wen-dan WEI Shuo-feng YAN Ti-zhen▲
Department of Medical Genetics,Liuzhou Maternity and Child Healthcare Hospital(Liuzhou Key Laboratory of Reproductive Medicine),Guangxi Zhuang Autonomous Region,Liuzhou 545001,China
Department of Medical Genetics,Liuzhou Maternity and Child Healthcare Hospital(Liuzhou Key Laboratory of Reproductive Medicine),Guangxi Zhuang Autonomous Region,Liuzhou 545001,China
[Abstract]Objective To explored the preimplantation genetic testing (PGT)in carriers of balanced translocations with different genders chromosome group composition situation and the influence of different parental sources on the chromosome formation of offspring.Methods The infertile couples who have undergone peripheral blood chromosome examination in Liuzhou Maternal and Child Health Hospital from January 2017 to June 2021 were selected for karyotype analysis,and balanced translocation carriers were screened out,and assisted reproductive technology was implemented for the balanced translocation carrier couples.Stage embryos use high-throughput sequencing technology for embryo PGT,and analyze and compare the types and composition of blastocyst stage embryo chromosomes of carriers of chromosomal balance translocations of different sexes.Results Through chromosome karyotype analysis,a total of 113 couples with one of them as carriers of balanced chromosomal translocation were screened,fourty-two female carriers and seventyone male carriers.Using high-throughput sequencing to perform preimplantation genetic testing for structural rearrangements(PGT-SR)detection,a total of 738 blastocyst stage embryos and obtained 168 transferable embryos were detected,126 were from male carriers,and 42 were from female carriers.The rate of obtaining transferable embryos,the rate of simple unbalanced embryos,the rate of sporadic abnormal embryos,and the rate of complex abnormal embryos were respectively 27.8%,19.6%,41.6%,and 38.8% of male interbalanced carriers.The rate of obtaining transferable embryos,the rate of simple unbalanced embryos,the rate of sporadic abnormal embryos,and the rate of complex abnormal embryos were respectively 15.5%,25.9%,32.9%,41.2% of female interbalanced carriers.The rate of transferable embryos from different parental sources was compared,with significantly different(27.8% from paternal origin,15.5% from maternal origin,χ2=15.253,P<0.05).There was no significant difference in the rate of unbalanced embryos(19.6% from paternal origin,25.9% from maternal origin,χ2=3.096,P>0.05).The rate of sporadic abnormal embryos from different parental origins was compared,with significantly different(41.6% from paternal origin,32.9% from maternal origin,χ2=4.310,P<0.05).There was no significant difference in the rate of complex abnormal embryos (38.8% from paternal origin,41.2% from maternal origin,χ2=0.320,P>0.05).Conclusion The rate of female reciprocal translocation carriers obtaining transferable embryos and the rate of sporadic abnormal embryos were significantly lower than those of male carriers,and the rates of simple unbalanced embryos and complex abnormal embryos were higher than those of male carriers.
[Key words]Karyotype;Balanced translocation carrier;Preimplantation genetic testing;High-throughput sequencing
[中图分类号]R714.8
[文献标识码]A
[文章编号]1674-4721(2021)11(b)-0009-06
[基金项目]广西壮族自治区卫生和计划生育委员会自筹经费科研课题(Z20170533、Z20180037、Z20180039、Z20180041)。
▲通讯作者
(收稿日期:2021-08-03)