超声引导下胸椎旁神经阻滞对单孔胸腔镜术后患者镇痛和细胞免疫的影响
倪欣欣
江苏省无锡市惠山区人民医院麻醉科,江苏无锡 214187
[摘要]目的 探讨超声引导下胸椎旁神经阻滞(TPVB)阻滞对单孔胸腔镜下肺部分切除术后患者镇痛和细胞免疫功能的影响。方法 选取2020年3—8月无锡市惠山区人民医院收治的60 例择期行单孔胸腔镜下肺部分切除术的患者作为研究对象,按照随机数字表法分成TPVB 组和对照组,每组各30 例。TPVB 组在全麻诱导插管后行超声引导下T4~5、T6~7 胸椎旁神经阻滞,确认无血、无气、无脑脊液后,分别注入0.5%的罗哌卡因10 mL。对照组在相同的胸椎旁间隙分别注入生理盐水10 mL。比较两组术中舒芬太尼和间羟胺的追加次数,术后24、48 h 的疼痛视觉模拟量表(VAS)评分,术后静脉自控镇痛(PCIA)的有效按压次数及麻醉诱导前、术后24、48 h CD4+、CD8+、CD3+的变化。结果 TPVB 组术中追加舒芬太尼及间羟胺的次数少于对照组,差异有统计学意义(P<0.05)。术后24、48 h,TVPB 组的VAS 评分均低于对照组,PCIA 有效按压次数均少于对照组,差异有统计学意义(P<0.05)。麻醉诱导前两组的CD4+、CD8+、CD3+水平比较,差异无统计学意义(P>0.05);术后24 h,TPVB 组的CD4+、CD8+、CD3+水平均高于对照组,术后48 h,TPVB 组的CD8+、CD3+水平高于对照组,差异有统计学意义(P<0.05)。结论 超声引导下单次胸椎旁神经阻滞可提高单孔胸腔镜下肺部分切除术后镇痛的效果,同时对T 淋巴细胞亚群水平进行有效的维持,减轻对患者细胞免疫的抑制。
[关键词]超声引导;胸椎旁神经阻滞;胸腔镜;细胞免疫
随着加速康复外科概念的提出,电视胸腔镜手术(video-assisted thoracic surgery,VATS) 因创伤小、术后恢复快,受到众多胸外科医生的推崇[1-3]。然而,即使是采用了这种微创手术,仍会出现无法避免的急慢性疼痛[4-5]。目前区域阻滞麻醉在促进胸外科手术患者的术后康复中开始发挥显著作用。除了传统的硬膜外阻滞镇痛外,临床上多采用阿片类药物静脉自控镇痛(patient-controlled intravenous analgesia,PCIA),但容易发生呼吸抑制、恶心、呕吐等不良反应,还可能抑制机体的免疫功能[6]。超声引导下胸椎旁神经阻滞(thoracic paravertebal block,TPVB)通过超声辅助将局麻药注射在出椎间孔的胸椎旁间隙内的脊神经附近,从而阻滞该侧的运动、感觉和交感神经,达到同侧躯体麻醉的效果,广泛适用于急慢性疼痛的控制与治疗、癌痛治疗、术后镇痛和复合麻醉等方面[7]。本研究拟探讨超声引导下胸椎旁神经阻滞对此类患者细胞免疫功能的影响,为临床麻醉选择提供参考。
1 资料与方法
1.1 一般资料
选取2020年3—8月无锡市惠山区人民医院收治的60 例择期行单孔胸腔镜下肺部分切除术的患者作为研究对象,按照随机数字表法分成TPVB 组和对照组,每组各30 例。TPVB 组中,男12 例,女18 例;年龄45~71 岁,平均(59.17±7.97)岁;ASA 分级:Ⅰ级13 例,Ⅱ级17 例; 麻醉时间100~175 min,平均(135.00±25.53)min。对照组中,男15 例,女15 例;年龄40~72 岁,平均(59.83±9.58)岁;ASA 分级:Ⅰ级11例,Ⅱ级19 例;麻醉时间100~180 min,平均(132.50±26.29)min。比较两组患者的性别、年龄、麻醉时间等一般资料,差异无统计学意义(P>0.05),具有可比性。本研究经无锡市惠山区人民医院医学伦理委员会审核批准,患者均知晓本研究并签署知情同意书。
纳入标准:①年龄40~75 岁;②ASA 分级为Ⅰ~Ⅱ级;③择期行单孔胸腔镜下肺部分切除术。排除标准:①合并严重心、肝、肺、肾系统疾病者;②合并精神系统疾病不能配合本研究者;③依从性差,无法配合完成研究者;④伴有神经阻滞禁忌证者。
1.2 方法
两组患者术前禁饮禁食,入室后开放外周静脉通路,常规监测无创血压、血脉氧饱和度、心电图。麻醉诱导,依次静脉给予丙泊酚(奥地利Fresenius Kabi Austria GmbH,生产批号:16NI5432)2 mg/kg、舒芬太尼(宜昌人福药业有限公司,生产批号:91A07191)0.5 μg/kg、罗库溴铵(浙江仙琚制药股份有限公司,生产批号:191004)0.6 mg/kg。3 min 预充氧后在可视喉镜下行双腔支气管插管,纤支镜定位无误后固定。所有患者的机械通气方案使用容量控制模式,潮气量4~6 mL/kg,吸呼比1:2,并调节呼吸频率,维持呼气末二氧化碳分压35~40 mmHg。超声引导下行右颈内静脉穿刺和桡动脉穿刺置管,用于抽取外周血和监测动脉血压。麻醉维持使用1%七氟烷(上海恒瑞医药有限公司,生产批号:19092031)吸入以及静脉泵注瑞芬太尼(宜昌人福药业有限公司,生产批号:90A09121)和丙泊酚,维持脑电双频指数 (bispectralindex,BIS)值40~50;术中追加罗库溴铵0.2 mg/kg 维持肌松,追加舒芬太尼用于加深麻醉,维持血压心率波动在基础值15%~20%,必要时使用血管活性药物间羟胺(北京市永康药业有限公司,生产批号:19070138)。待进胸后行单肺通气,适当减小潮气量。在手术开始前,两组患者由同一位麻醉医师行超声引导下TPVB。手术结束后连接PCIA,待患者清醒,拔除支气管导管,并送至麻醉恢复室,观察30 min 后无特殊,转移至胸外科病房。
TPVB 组:取侧卧位,术侧在上,在便携式二维超声引导下,T4 胸椎棘突下缘旁开2.5 cm 处为穿刺点,可见随呼吸移动的强回声胸膜亮线,确定T4 横突位置后,在横突外侧胸膜上可见楔形低回声区的椎旁间隙,平面内进针,回抽确认无血、气、脑脊液后,注入0.5%的罗哌卡因(河北一品制药有限公司,生产批号:C009190908)10 mL,观察到高亮胸膜影下压、胸膜向腹侧推移的超声图像,确认阻滞成功。再在T6 横突位置执行同样操作。对照组:由同一位麻醉医师在超声引导下行T4~5、T6~7 胸椎旁神经阻滞,但分别注入生理盐水10 mL。
术后两组患者均采用PCIA,配方为舒芬太尼50 μg,用生理盐水配置100 mL,负荷剂量2 mL,背景剂量2 mL/h,自控每次0.5 mL,锁定时间15 min。在术前访问期间,对所有患者宣教,相关注意事项及视觉模拟评分(visual analogue scale,VAS)使用方法及原理,总分为0~10 分,其中0 分表示无痛,评分越高表示患者的疼痛程度越严重[8]。每位患者在术后24、48 h 进行VAS 疼痛评估。当VAS 评分≥4 时,静脉注射30 mg 酮咯酸氨丁三醇(山东新时代药业有限公司,生产批号:035191109)作为补救镇痛措施。
1.3 观察指标
①主要观察诱导前、术后24、48 h 免疫指标的变化,包括CD4+、CD8+、CD3+水平。②观察记录相关临床指标,包括术中舒芬太尼、间羟胺的追加次数;两组患者术后24、48 h 的VAS 评分及PCIA 的有效按压次数。
1.4 统计学方法
采用SPSS 23.0 软件分析处理数据。首先使用K-S检验确定连续计量资料数据分布的正态性,符合正态分布的计量资料用均数±标准差(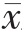 ±s)表示,两组间比较采用t 检验,重复测量资料采用重复测量方差分析,不符合正态分布者转换为正态分布后行统计学分析;计数资料采用率表示,组间比较采用χ2 检验,以P<0.05 为差异有统计学意义。
±s)表示,两组间比较采用t 检验,重复测量资料采用重复测量方差分析,不符合正态分布者转换为正态分布后行统计学分析;计数资料采用率表示,组间比较采用χ2 检验,以P<0.05 为差异有统计学意义。
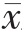 ±s)表示,两组间比较采用t 检验,重复测量资料采用重复测量方差分析,不符合正态分布者转换为正态分布后行统计学分析;计数资料采用率表示,组间比较采用χ2 检验,以P<0.05 为差异有统计学意义。
±s)表示,两组间比较采用t 检验,重复测量资料采用重复测量方差分析,不符合正态分布者转换为正态分布后行统计学分析;计数资料采用率表示,组间比较采用χ2 检验,以P<0.05 为差异有统计学意义。2 结果
2.1 术中两组舒芬太尼及间羟胺追加次数的比较
TPVB 组舒芬太尼及间羟胺追加次数少于对照组,差异有统计学意义(P<0.05)(表1)。
表1 术中两组舒芬太尼及间羟胺追加次数的比较(次,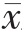 ±s)
±s)
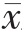 ±s)
±s).jpg)
2.2 两组患者术后24、48 h VAS 评分和PCIA 有效按压次数的比较
VAS 评分方面,术后24、48 h,TVPB 组的VAS 评分均低于对照组,差异有统计学意义(P<0.05);对照组术后48 h VAS 评分高于术后24 h,差异有统计学意义(P<0.05);TVPB 组术后24 h 与术后48 h 的VAS评分比较,差异无统计学意义(P>0.05)(表2)。
PCIA 有效按压次数方面,两组术后48 h 的PCIA有效按压次数均多于术后24 h,差异有统计学意义(P<0.05); 术后24、48 h,TVPB 组的PCIA 有效按压次数均少于对照组,差异有统计学意义(P<0.05)(表2)。
表2 两组患者不同时间点VAS 评分和PCIA 有效按压次数的比较(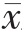 ±s)
±s)
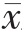 ±s)
±s).jpg)
2.3 两组患者不同时间点免疫细胞水平比较
整体分析发现,CD4+、CD8+、CD3+水平的时间点、组间比较及交互作用,差异均有统计学意义(P<0.05)。诱导前两组的CD4+、CD8+、CD3+水平比较,差异无统计学意义(P>0.05);术后24 h,TPVB 组的CD4+、CD3+水平低于诱导前,CD8+高于诱导前,且TPVB 组的CD4+、CD8+、CD3+水平均高于对照组,差异有统计学意义(P<0.05);术后48 h,TPVB 组的CD8+、CD3+水平高于对照组,差异有统计学意义(P<0.05);TPVB 组术后48 h 的CD4+、CD8+、CD3+均恢复至诱导前水平(表3)。
表3 两组患者不同时间点免疫细胞水平的比较(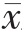 ±s)
±s)
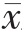 ±s)
±s).jpg)
与本组诱导前比较,aP<0.05;与对照组同时间点比较,bP<0.05
3 讨论
本研究选择单孔VATS 来消除不同开孔数量相关的胸壁损伤所产生的干扰,用舒芬太尼配置PCIA辅助镇痛,比使用吗啡的不良反应更少。考虑到神经阻滞的有效性与安全性,本研究参考文献[9-11],选用0.5%的罗哌卡因20 mL 行神经阻滞。
相同类型的文章对患者细胞免疫的研究相对较少,因此本研究对患者的免疫细胞和炎症因子进行了测试。在T 淋巴细胞亚群中[12],当CD3+细胞数量减少,T 细胞的抗原受体对抗原呈递细胞上主要组织相容性复合物上的的抗原决定簇的识别能力就会降低,削弱患者的免疫功能;CD4+细胞刺激其他免疫细胞产生直接的免疫反应,通过分泌细胞因子来增殖、活化和提高CD8+细胞消灭肿瘤细胞的能力,甚至有直接消灭肿瘤细胞和免疫记忆的功能;CD8+细胞直接杀伤靶细胞,同时抑制合成抗体、分泌抗体及T 细胞增殖。机体通过分泌免疫抑制因子,导致CD4+ T 细胞抗原减少,CD8+T 细胞反应性增多,而增多的抑制性CD8+ T 细胞又反过来抑制CD4+T 细胞[13]。本研究中TPVB 组追加舒芬太尼、 间羟胺的次数和术后PCIA 的有效按压次数少于对照组,术后24 h,TPVB 组CD4+、CD8+、CD3+均高于对照组(P<0.05),提示TPVB 能对患者的T 淋巴细胞亚群水平进行有效的维持,可能是由于超声引导下TPVB 可以阻断术中产生的神经冲动的传导,降低对免疫应答的灵敏程度,抑制交感神经的活性,同时减少了过多的阿片类药物的使用,削弱阿片类药物对吞噬细胞活性的抑制,最大程度地保护了患者的细胞免疫功能。患者因手术创伤等因素导致CD4+、CD3+明显降低,尽管在术后有所回升,但仍维持较低水平,故其细胞免疫功能受到了明显抑制。考虑是术中肺组织受到一定的牵拉和刺激,炎症细胞因子被激活并释放入血,进一步损伤肺组织削弱机体的免疫防御功能。两组患者虽然都采用相同的术后镇痛方式,TPVB 组患者因术前行超声引导下神经阻滞,有效的阻断了手术区域的伤害性刺激向交感神经低级中枢的传导[14-16],有效缓解了患者疼痛感,同时降低了炎症细胞因子的释放水平,减少了机体的应激反应,保护患者的细胞免疫功能。
Geoffroy L 等[17]的研究发现,疼痛信号可以激活肾上腺素轴-垂体-下丘脑及中枢神经系统,从而使前肾上腺素、儿茶酚胺、糖皮质激素释放增加。而T 淋巴细胞、自然杀伤细胞(natural killer cell,NK)表面表达为β-肾上腺素和糖皮质激素受体,儿茶酚胺或者糖皮质激素与受体结合,并对激活蛋白及转录因子起作用,通过抑制细胞内信号的传导[18-19]而对细胞免疫产生抑制。因此,术后疼痛对免疫细胞的影响很大,特别是当呼吸道分泌物因咳嗽时疼痛无法有效排出时,易引起更严重的并发症。本研究中TPVB 组术中舒芬太尼的追加次数少,考虑为单侧胸交感阻滞,局麻药阻断了伤害性感受传入纤维,降低神经敏化,从而增强了镇痛效果,减少了术中镇痛药物的使用。两组患者术后的VAS 评分和PCIA 的有效按压次数均随着时间的延长而递增,说明疼痛随着时间递增而逐渐加重。术后24 h 两组VAS 疼痛评分比较,TVPB 组明显低于对照组,术后48 h TVPB 组的VAS 疼痛评分低于术后24 h,PCIA 有效按压次数低于对照组,差异有统计学意义(P<0.05),都说明了超声引导下TPVB 术后镇痛效果较好。
然而,本研究尚有一些不足和需要改进的地方。首先,本研究样本量较少,且均来自一个中心,有待大样本量多中心的研究进一步探讨。其次,采用的是单次注药而不是持续置管注药,后者可进一步延长阻滞的时间和效果。最后,只选择了几个时间点来检测细胞免疫指标,在监测过程中仍存在一些干扰因素,监测结果也可能会出现假阳性和假阴性的可能。
综上所述,超声引导下胸椎旁神经阻滞能对患者的T 淋巴细胞亚群水平进行有效的维持,减轻对患者细胞免疫的抑制,故而对实施单孔胸腔镜术后的患者的细胞免疫功能具有显著的保护作用,同时减少术中、 术后舒芬太尼用量和术中间羟胺的追加次数,提高术后镇痛的效果。
[参考文献]
[1]杨岩岩.快速康复外科理念对肺癌术后肺部感染的预防及血清炎性因子变化[J].中国老年学杂志,2020,40(8):1622-1624.
[2]白玉树,翟骁,陈自强,等.退变性脊柱侧凸手术加速康复外科围手术期管理策略专家共识[J].第二军医大学学报,2020,41(3):233-242.
[3]曾添洋,陈力.加速康复外科在胸腔镜肺切除术患者中的应用研究[J].重庆医科大学学报,2020,45(6):804-808.
[4]孔庆芝,邢飞,张卫.胸部手术后慢性疼痛危险因素及预防[J].国际麻醉学与复苏杂志,2019,40(3):270-274.
[5]李锦豪.术后急慢性疼痛关系的研究进展[J].中外医疗,2018,37(6):196-199.
[6]Moyano J,Aguirre L.Opioids in the immune system:from experimental studies to clinical practice[J].Rev Assoc Med Bras,2019,65(2):262-270.
[7]Ashwini S,Geeta S,Manoj K,et al.Comparison of efficacy of ultrasound-guided pectoral nerve block versus thoracic paravertebral block using levobupivacaine and dexamethasone for postoperative analgesia after modified radical mastectomy:A randomized controlled trial[J].Saudi J Anaesth,2019,13(4):325-331.
[8]赵道霞,张保应,张阿锋,等.舒芬太尼预防性镇痛对剖宫产术产妇VAS 评分及应激指标影响[J].中国计划生育学杂志,2020,28(10):1688-1690.
[9]张海燕,李崎,朱涛,等.胸椎旁阻滞的临床应用[J].国际麻醉学与复苏杂志,2017,38(12):1117-1127.
[10]Anindya M,Anjan D,Nairita M,et al.Comparative evaluation of analgesic sparing efficacy between dexmedetomidine and clonidine used as adjuvant to ropivacaine in thoracic paravertebral block for patients undergoing breast cancer surgery:A prospective,randomized,double -blind study[J].Saudi J Anaesth,2018,12(4):548-554.
[11]Kulhari S,Bharti N,Bala I,et al.Efficacy of pectoral nerve block versus thoracic paravertebral block for postoperative analgesia after radical mastectomy:a randomized controlled trial[J].Br J Anaesth,2016,117(3):382-386.
[12]Hu X,Zhang J,Wang J,et al.Landscape of B cell immunity and related immune evasion in human cancers[J].Nat Genet,2019,51(3):560-570.
[13]Rossella T,Fabiola A,Alberto B,et al.Biological agents in rheumatoid arthritis:A cross-link between immune tolerance and immune surveillance[J].Curr Rheumatol Rev,2018,14(2):131-139.
[14]曹志方,林添华,沈熠等.全麻开腹手术患者术前疼痛敏感度与抑制伤害性刺激反应麻醉药物用量的相关性研究[J].中国临床实用医学,2016,7(3):52-53.
[15]Renaud R,Etienne S,Pierre A,et al.Correlation between incremental remifentanil doses and the Nociception Level(NOL) index response after intraoperative noxious stimuli[J].Front Mol Neurosci,2019,99(9):1049-1061.
[16]胡静,丁毅,史斌.超声引导下胸椎旁神经阻滞在胸腔镜肺叶切除术围术期快速康复中的应用[J].广东医学,2019,40(4):216.
[17]Geoffroy L,Jiacheng M,Alfred J,et al.T cells as an emerging target for chronic pain therapy[J].Front Mol Neurosci,2019,12(12):216.
[18]费雪瑜,邰昭霞,王涵芝,等.P2X 受体介导慢性疼痛的研究进展[J].世界中医药,2019,14(6):1363-1367.
[19]Bennett DL,Clark AJ,Huang J,et al.The role of voltagegated sodium channels in pain signaling[J].Physiol Rev,2019,99(2):1079-1151.
Effect of ultrasound-guided thoracic paravertebral block on analgesic and cellular immune function in patients with video-assisted single-hole thoracic surgery
NI Xin-xin
Department of Anesthesiology, Wuxi Huishan District People′s Hospital, Jiangsu Province, Wuxi 214187, China
Department of Anesthesiology, Wuxi Huishan District People′s Hospital, Jiangsu Province, Wuxi 214187, China
[Abstract] Objective To explore the effect of ultrasound-guided thoracic paravertebral block (TPVB) on analgesic and cellular immune function in patients with video-assisted single-hole thoracic surgery. Methods A total of 60 patients who underwent selective single-port thoracoscopic partial pneumonectomy in Wuxi Huishan District People′s Hospital from March to August 2020 were selected as the research subjects. According to random number table method, they were divided into TPVB group and control group, with 30 patients in each group. In TPVB group, T4-5, T6-7 thoracic paravertebral nerve block was performed under ultrasonic guidance after intubation induced by general anesthesia. After confirming that there was no blood, no gas, and no cerebrospinal fluid, 10 mL 0.5% ropivacaine was injected, respectively. In the control group, 10 mL of normal saline was injected into the same thoracic paravertebral space. The number of sufentanil and methydroxyamine additions during surgery, visual analogue scale (VAS) scores 24 and 48 h after surgery, the number of effective pressure on patient controlled intravenous analgesia (PCIA), and the changes of CD4+,CD8+and CD3+before and 24 and 48 h after anesthesia induction were compared between the two groups. Results The number of intraoperative sufentanil and hydroxyamine supplementation in TPVB group was less than that in control group, the difference was statistically significant (P<0.05). 24 and 48 h after surgery, the VAS scores of TVPB group were lower than the control group, and the effective times of PCIA compression were less than the control group, the differences were statistically significant (P<0.05). There was no significant difference in the levels of CD4+, CD8+ and CD3+ between the two groups before anesthesia induction (P>0.05). 24 h after operation, CD4+, CD8+, CD3+ levels in TPVB group were higher than those in control group, 48 h after operation, CD8+ and CD3+ levels in TPVB group were higher than those in control group, the differences were statistically significant (P<0.05). Conclusions Ultrasound-guided thoracic paravertebral nerve block can not only improve the effect of analgesia, but also maintain the T-lymphocyte subgroup level and reduce the inhibition of cellular immunity of patients with uniportal video-assisted thoracoscopic surgery.
[Key words] Ultrasound-guided; Thoracic paravertebal block;Video-assisted thoracoscopic surgery; Cellular immune function
[中图分类号] R614.2
[文献标识码] A
[文章编号] 1674-4721(2021)7(c)-0156-04
(收稿日期:2021-01-26)