骨髓形态联合免疫分型检测在慢性淋巴细胞白血病中的应用
周月平
江西省抚州市第一人民医院检验科,江西抚州 344000
[摘要]目的 探讨骨髓形态联合免疫分型检测在慢性淋巴细胞白血病中的应用。方法 选取我院2015年5月~2018年12月收治的80例慢性淋巴细胞白血病患者的临床资料,均采用流式细胞术对骨髓或者外周血标本进行免疫表型检测。依据细胞形态学差异分为典型组(65例)和混合组(15例)。分析骨髓形态学特征和免疫分型情况,比较两组抗原表达阳性率。结果 骨髓形态学特征方面,所有患者淋巴细胞比例明显增高,伴有不同比例的幼稚淋巴细胞、粒系、红系及巨核系表现不同程度减少。80例患者中,抗原表达阳性率由高到低依次为CD19、HLA-DR、CD5、CD20、CD22、CD23、CD38、FMC-7。两组CD5、CD19、CD20、CD22、CD23、FMC-7和HLA-DR阳性表达率比较,差异无统计学意义(P>0.05),但混合组CD38的阳性表达率高于典型组,差异有统计学意义(P<0.05)。结论 慢性淋巴细胞白血病的临床检查中,骨髓形态联合免疫分型检测具有一定的诊断和鉴别效果,但仍需进一步探究证实。
[关键词]白血病;淋巴细胞;免疫分型;骨髓形态
白血病是临床致死率最高的疾病之一,是世界各国卫生组织高度关注的疾病类型。慢性淋巴细胞白血病是淋巴细胞的恶性增殖性疾病,在临床上并不少见,具有一定的发病率,其主要特点为看似成熟的小淋巴细胞聚集在了外周血液、骨髓、外周淋巴器官[1]。近年来,慢性淋巴细胞白血病的发病率逐年上升,严重威胁到人类的身体健康和生命安全。因此,加强对该病的检测研究,对临床诊治和预后的改善有十分积极的意义[2]。骨髓形态检测和免疫分型检测在淋巴细胞恶性增生性疾病的检测中已被广泛使用,取得了良好的检测效果。但是从临床关于慢性淋巴细胞白血病的检测研究中,关于骨髓形态学联合免疫分型检测的报道并不多见,二者联合检测的价值如何,仍旧有待进一步深入探究[3]。对于慢性淋巴细胞白血病患者而言,科学有效地检测直接影响着治疗的效果和预后的改善,加强对骨髓形态联合免疫分型检测的应用研究至关重要[4]。为此,本研究收集慢性淋巴细胞白血病患者临床资料,通过对骨髓形态联合免疫分型检测的价值展开分析,旨在为临床诊治提供理论参考,现报道如下。
1 资料与方法
1.1 一般资料
选取我院2015年5月~2018年12月收治的80例慢性淋巴细胞白血病患者,按照细胞形态学差异分为典型组(65例)和混合组(15例)。典型组中,男35例(53.84%),女30例(46.16%);年龄28~87岁,平均(51.65±2.38)岁。混合组中,男9例(60.00%),女6例(40.00%);年龄29~88岁,平均(51.72±2.42)岁。两组患者一般资料比较,差异无统计学意义(P>0.05),具有可比性。本研究经我院医学伦理委员会批准。纳入标准:①经临床症状及外周血淋巴细胞、特征性淋巴细胞形态学确诊为慢性淋巴细胞白血病;②患者年龄≥20岁;③入组者一般资料完整。排除标准:①重要脏器功能受损,生命体征异常波动;②合并其他类型白血病;③认知水平有限,配合度差;④中途退出。
1.2 方法
两组患者均进行骨髓形态学和免疫分型检查。(1)骨髓形态学检查[5-6]:抽取的骨髓组织迅速涂片3~5张,涂片制成后应迅速扇干进行吉姆萨染色,每份骨髓涂片分出200~500个有核细胞,髓涂片有骨髓小粒、镜下可见骨髓中特有的细胞表明取材良好,如巨核细胞、浆细胞等。除骨髓片外,应同时附2~3张血片和病历摘要一份,由专业的人员进行细胞形态学分析,低倍镜检查:①观察取材、涂片、染色情况。②根据成熟红细胞与有核细胞之比来判断骨髓增生程度。③观察图片中有无特殊异常细胞。④低倍镜计数全片巨核细胞数量。严格按照慢性淋巴细胞白血病的诊断方式进行确诊。(2)免疫分型检查:取患者肝素抗凝的骨髓液和外周的血液3~5 ml,通过淋巴细胞分离液分离获得单个细胞核,采用专门的仪器检测单克隆抗体,抗体类型有:CD5、CD19、CD20、CD22、CD23、FMC-7和HLA-DR、CD38。阳性标准:白血病细胞表面抗原阳性率≥20%为阳性。
1.3 统计学方法
采用SPSS 13.0统计学软件进行数据分析,计量资料用均数±标准差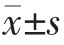 表示,两组间比较采用t检验;计数资料用百分比(%)表示,组间比较采用χ2检验,以P<0.05为差异有统计学意义。
表示,两组间比较采用t检验;计数资料用百分比(%)表示,组间比较采用χ2检验,以P<0.05为差异有统计学意义。
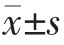 表示,两组间比较采用t检验;计数资料用百分比(%)表示,组间比较采用χ2检验,以P<0.05为差异有统计学意义。
表示,两组间比较采用t检验;计数资料用百分比(%)表示,组间比较采用χ2检验,以P<0.05为差异有统计学意义。2 结果
2.1 骨髓形态学特征
所有患者骨髓象增生度均达活跃-极度活跃,淋巴细胞比例明显增高,多为类似成熟的小淋巴细胞,伴有不同比例的幼稚淋巴细胞、粒系、红系及巨核系表现不同程度减少。
2.2 免疫分型分析
80例患者中,抗原表达阳性率,CD5为90.00%,CD19为97.50%,CD20为80.00%,CD22为77.50%,CD23为67.50%,FMC-7为15.00%,HLA-DR为93.75%,CD38为36.25%。
2.3 两组抗原表达阳性率的比较
典型组和混合组患者的CD5、CD19、CD20、CD22、CD23、FMC-7和HLA-DR阳性表率比较,差异无统计学意义(P>0.05)。混合组CD38阳性表达率高于典型组,差异有统计学意义(P<0.05)(表1)。
表1 两组抗原表达阳性率的比较[n(%)]
.jpg)
3 讨论
慢性淋巴细胞白血病是一种异质性较大的成熟B淋巴细胞肿瘤,表现为肝脾淋巴结肿大和外周血中多见表达CD5+的淋巴细胞。慢性淋巴细胞白血病在西方人群较常见,年发病率约5/10万,但在亚洲人群的发病率则明显低于白种人,提示了慢性淋巴细胞白血病的发生过程中存在种族差异[7]。有些研究还发现,亚洲国家慢性淋巴细胞白血病患者的分子遗传学特征,如免疫球蛋白重链可变区(IgVH)突变情况和西方国家患者明显不同,这意味着亚洲慢性淋巴细胞白血病患者可能有独特的临床和分子遗传学特点[8]。根据幼稚淋巴细胞在淋巴细胞中所占的不同比例可将慢性淋巴细胞白血病分为3种亚型:①典型慢性淋巴细胞白血病,90%以上为类似成熟的小淋巴细胞;②慢性淋巴细胞白血病伴随幼淋细胞增多,幼稚淋巴细胞10%~54%;③混合细胞型,有不同比例的不典型淋巴细胞,幼稚淋巴细胞<10%。本组80例慢性淋巴细胞白血病患者中65例为典型慢性淋巴细胞白血病,形态学表现以体积较小的类似成熟小淋巴细胞为主,15例为混合型慢性淋巴细胞白血病,幼稚细胞胞体较大,核浆比减低,胞浆呈不同程度嗜碱性。
外周血液/骨髓细胞形态学检查是慢性淋巴细胞白血病最基本的诊断方式。细胞免疫分型是断定血液恶性肿瘤的重要参考之一,对于慢性淋巴细胞的断定、预后等有着重要的作用。慢性淋巴细胞白血病属于B淋巴细胞肿瘤[9-11],主要临床特点是CD5为阳性细胞,当CD5+、CD10+共同表达CD23、CD20,对于CD22弱化表达,并且不表达出CD79b,FMC7。本研究中,慢性淋巴细胞白血病抗原表达阳性最高的是CD19,然后依次是HLA-DR、CD5、CD20、CD22、CD23、CD38,说明慢性淋巴细胞白血病可同时表达CD19、CD5、CD20、CD22,这些指标均可用于慢性淋巴细胞白血病的判定。通常情况下,CD5为该疾病的主要特征,但并不排除CD5结果为阴性慢性淋巴细胞白血病患者的存在[12-14]。据相关报道指出,也有7%~20%的患者不表达CD5[15-16],该结论和本实验数据吻合,本实验数据有8例为阴性。因此对CD5呈阴性且CD19和CD20为阳性的患者进行诊断时,应联合细胞形态学、遗传学和临床表现等影响因素,以提高诊断准确性[17]。有学者在研究中发现[18],CD38阳性表达者无进展生存期明显短于CD38阴性表达者,对药物敏感度低,疾病进展快,治疗效果有限。由此可见典型的慢性淋巴细胞白血病患者预后良好,临床给予骨髓形态联合免疫分型监测,对于疾病治疗可提供一定的指导意义。
综上所述,在慢性淋巴细胞白血病中骨髓形态联合免疫分型检测的应用,能够为疾病的诊断检查提供参考价值。当然本次研究时长和样本数量存在局限性,所得结论可信度有限,应在后期适当增加病例数,延长研究时长,以获得更具参考价值的研究结果。
[参考文献]
[1]Uckun FM,Nachman JB,Sather HN,et al.Clinical significance of Philadelphia chromosome positive pediatric acute lymphoblastic leukemia in the context of contemporary intensive therapies:a report from the children′s cancer group[J].Cancer,2015,83(9):2030-2039.
[2]Musa Y,Hagop K,Farhad R,et al.Philadelphia chromosomepositive acute lymphoblastic leukemia in adults:current treatments and future perspectives[J].Clin Advan Hematol Oncol,2018,16(3):216-223.
[3]吴建伟,黄建栩,郑荣,等.青黄散组分抑制BCL-2、XIAP-1、c-IAP协同诱导KG1a细胞凋亡的实验研究[J].中国当代医药,2018,25(18):10-16.
[4]况丽平,程源山,杨琪玫,等.CD5/CD23阴性慢性淋巴细胞白血病临床病理观察[J].诊断病理学杂志,2017,24(8):608-610,613.
[5]陈小剑,熊树民,张敏,等.骨髓形态学检查在“贫血待查”中的诊断价值——附952例病例分析[J].诊断学理论与实践,2002,1(2):106-108.
[6]马勤芬,周惠芬,朱明清,等.51例慢性淋巴细胞白血病的免疫表型及细胞遗传学特征研究[J].中国实验血液学杂志,2007,15(4):696-699.
[7]Julia W,Nitin J,Marina K.Philadelphia chromosome-like acute lymphoblastic leukemia:Progress in a new cancer subtype[J].Clin Adv Hematol Oncol,2017,15(7):554-561.
[8]汪梅花,赵康.流式细胞术在急性白血病免疫分型中的临床应用[J].中国医刊,2018,53(11):1233-1235.
[9]苏淼.微RNA及B细胞受体信号通路在慢性淋巴细胞白血病中的研究进展[J].白血病·淋巴瘤,2017,26(7):432-436.
[10]叶玉昌,许莲蓉.慢性淋巴细胞白血病/小淋巴细胞淋巴瘤的研究进展[J].国际输血及血液学杂志,2017,40(4):349-353.
[11]杨惠聪,吴阿阳,林洁,等.多重聚合酶链反应技术与流式细胞术在B细胞非霍奇金淋巴瘤骨髓侵犯的鉴别诊断比较分析[J].实用医技杂志,2019,26(6):677-679.
[12]张素琴,王春美,刘玉峰,等.急性淋巴细胞白血病患儿骨髓白血病细胞中microRNA-195及Bcl-2mRNA表达的意义[J].中华实用儿科临床杂志,2017,32(15):1170.
[13]李姮,熊文婕,刘慧敏,等.慢性淋巴细胞白血病503例临床及实验室特征回顾性分析[J].白血病·淋巴瘤,2017,26(6):325.
[14]张京,杨柯,白海,等.血液病骨髓涂片与骨髓病理活检诊断对比分析[J].检验医学与临床,2017,14(3):408-410.
[15]胡建娥,杨丽萍,李良琼.38例慢性淋巴细胞白血病的诊断分析[J].检验医学与临床,2017,14(Z2):138-141.
[16]林慧玲,李彦媚,叶铁真,等.基因扫描在初诊急性淋巴细胞白血病患儿Ig/TCR基因重排克隆性分析中的应用[J].中华检验医学杂志,2013,36(3):228-232.
[17]汪月增,季红,阎影,等.慢性淋巴细胞白血病的临床免疫分型和细胞周期分析[J].解放军医学院学报,1990,11(2):107-110.
[18]邵洋,胡延平,刘勇.慢性淋巴细胞白血病患者长链非编码RNA RP5-180C18.1的表达及其预后评价作用[J].中国医科大学学报,2018,47(4):341-345.
Application of marrow morphology combined immunotyping in chronic lymphoblastic leukemia
ZHOU Yue-ping
Department of Clinical Laboratory,Fuzhou First People′s Hospital,Jiangxi Province,Fuzhou 344000,China
Department of Clinical Laboratory,Fuzhou First People′s Hospital,Jiangxi Province,Fuzhou 344000,China
[Abstract]Objective To explore the application of bone marrow morphology combined with immunotyping in chronic lymphocytic leukemia.Methods From May 2015 to December 2018,80 patients with chronic lymphocytic leukemia admitted to our hospital were tested for immunophenotypes in bone marrow or peripheral blood samples by flow cytometry.Immunophenotype detection was performed on bone marrow or peripheral blood samples by flow cytometry.According to the cell morphology,they were divided into typical group (65 cases)and mixed group(15 cases).The morphological characteristics and immunotyping of bone marrow were analyzed,and the positive rates of antigen expression in the two groups were compared.Results In terms of the morphological characteristics of bone marrow,the proportion of lymphocytes increased significantly in all patients,accompanied by different proportions of juvenile lymphocytes,granulocytes,red lines and megakaryons showed different degrees of decrease.Among the 80 patients,the positive rates of antigen expression were CD19,HLA-DR,CD5,CD20,CD22,CD23,CD38 and FMC-7 in descending order.There were no statistically significant differences in the positive expression rates of CD5,CD19,CD20,CD22,CD23,FMC-7and HLA-DR between the two groups(P>0.05),but the positive expression rate of CD38 in the mixed group was higher than that in the typical group,the difference was statistically significant(P<0.05).Conclusion In the clinical examination of chronic lymphocytic leukemia,bone marrow morphology combined with immunotyping has certain diagnostic and differential effects,but it still needs to be further confirmed.
[Key words]Leukemia;Lymphocyte;Immunotyping;Bone marrow morphology
[中图分类号]R44
[文献标识码]A
[文章编号]1674-4721(2020)8(c)-0158-03
[基金项目]江西省抚州市社会发展指导性科技计划项目(抚科计字[2018]20号-29)
(收稿日期:2019-12-31)