脓毒症患者并发毛细血管渗漏综合征的危险因素分析
杨文韬 林 棱 陈 凝
福建省立金山医院内科,福建福州 350028
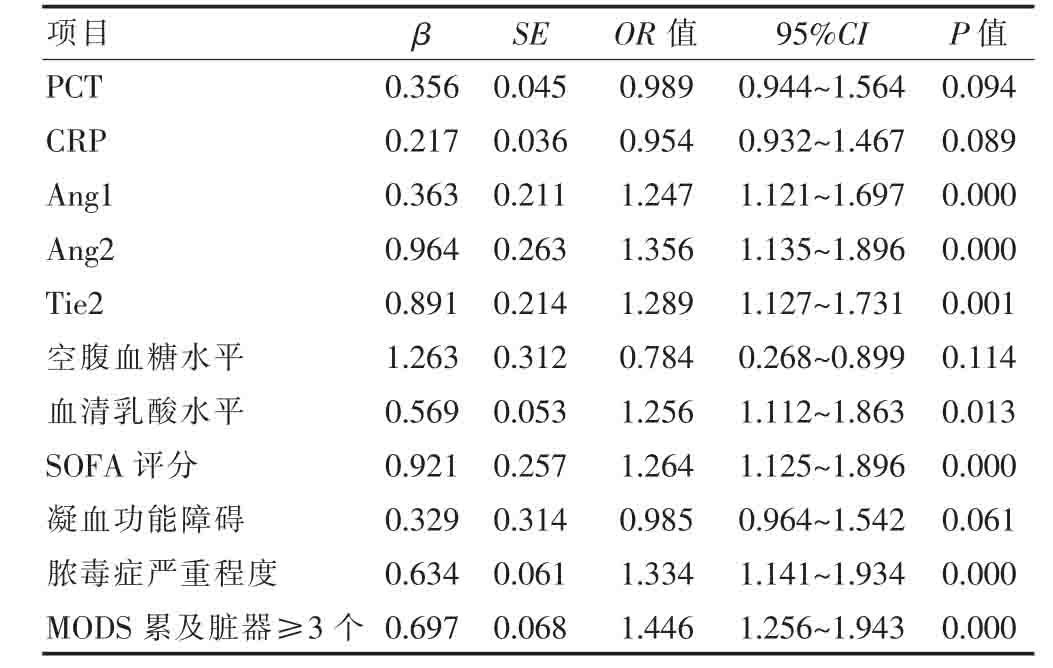
[摘要]目的 研究脓毒症患者并发毛细血管渗漏综合征的危险因素。方法 选取2017年10月~2018年9月我院收治的100例脓毒症患者作为研究对象,根据患者是否并发毛细血管渗漏综合征分为渗漏组(13例,并发毛细血管渗漏综合征)和非渗漏组(87例,未并发毛细血管渗漏综合征),统计并比较两组患者的临床资料,分析脓毒症患者并发毛细血管渗漏综合征的危险因素。结果 渗漏组患者的降钙素原(PCT)、C反应蛋白(CRP)、促血管生成素-2(Ang2)、血管生成素受体2 抗体(Tie2)、空腹血糖、血清乳酸水平以及全身性感染相关性器官功能衰竭(SOFA)评分均高于非渗漏组,促血管生成素-1(Ang1)水平低于非渗漏组,凝血功能障碍及多器官功能障碍综合征(MODS)累及脏器≥3个的发生率高于非渗漏组,脓毒症严重程度重于非渗漏组,差异均有统计学意义(P<0.05);Logistic多因素分析结果显示,Ang1 水平下降[β=0.363,OR=1.247,95%CI(1.121,1.697)]、Ang2 [β=0.964,OR=1.356,95%CI(1.135,1.896)]及Tie2 受体水平升高[β=0.891,OR=1.289,95%CI(1.127,1.731)]、高血清乳酸水平[β=0.569,OR=1.256,95%CI(1.112,1.863)]、高SOFA评分[β=0.921,OR=1.264,95%CI(1.125,1.896)]、脓毒症病情严重[β=0.634,OR=1.446,95%CI(1.141,1.934)]、MODS 累及脏器≥3个[β=0.697,OR=1.446,95%CI(1.256,1.943)],均是脓毒症患者并发毛细血管渗漏综合征的危险因素(P<0.05)。结论 Ang1 水平下降、Ang2及Tie2 受体水平升高、高血清乳酸水平、高SOFA评分、脓毒症病情严重、MODS 累及脏器≥3个,均是脓毒症患者并发毛细血管渗漏综合征的危险因素。
[关键词]脓毒症;毛细血管渗漏综合征;危险因素;乳酸;促血管生成素-1;促血管生成素-2;血管生成素受体2 抗体
脓毒症是由感染引起的全身炎症综合征,具有较高的死亡率,严重威胁着患者的生命健康[1]。由于多系统的、难以控制的毛细血管渗漏引起的多器官功能障碍是影响脓毒症患者预后,导致脓毒症患者死亡的主要原因,因此必须积极预防脓毒症患者发生毛细血管渗漏综合征,而目前关于脓毒症患者发生毛细血管渗漏综合征危险因素的研究较少,对于脓毒症患者发生毛细血管渗漏综合征防治措施的制定尚缺乏指导性依据[2-3]。基于此,本研究选取我院收治的100例脓毒症患者作为研究对象,分析脓毒症患者并发毛细血管渗漏综合征的危险因素,旨在找到可以有效防治脓毒症患者并发毛细血管渗漏综合征的方法,并为临床医师准确判断脓毒症患者的病情及早期治疗干预提供理论参考,现报道如下。
1 资料与方法
1.1 一般资料
选取2017年10月~2018年9月我院收治的100例脓毒症患者作为研究对象,其中男53例,女47例;年龄26~73岁,平均(49.69±4.98)岁。根据患者是否并发毛细血管渗漏综合征分为渗漏组(13例,并发毛细血管渗漏综合征)和非渗漏组(87例,未并发毛细血管渗漏综合征)。本研究已经我院医学伦理委员会审核批准。
纳入标准: ①符合2016年2月美国危重病医学会/欧州危重病医学会(SCCM/ESICM)联合发布的脓毒症3.0 定义及诊断分类标准[4];②临床资料完整者;③发病后6 h 内入院。排除标准:①既往有心功能不全、心肌梗死、慢性肾功能不全、恶性肿瘤、自身免疫性疾病、慢性病终末期者;②年龄<18岁者;③入院5 d 内死亡者;④近期有外伤、感染或发热者。
1.2 方法
统计并比较两组患者的临床资料,主要包括性别、年龄、营养不良情况、血清降钙素原(PCT)水平、血清C反应蛋白(CRP)水平、血清血管生成素1(Ang1)、血清血管生成素2(Ang2)及血管生成素受体2 抗体(Tie2)水平、空腹血糖水平、血清乳酸水平、全身性感染相关性器官功能衰竭(SOFA)评分、凝血功能障碍发生情况、脓毒症严重程度以及多器官功能障碍综合征(MODS)累及脏器≥3个的发生情况,同时采用多因素Logistic回归分析法分析脓毒症患者并发毛细血管渗漏综合征的危险因素。
1.3 评价标准
①SOFA评分包括呼吸、肾脏检查各2项,凝血、肝、神经检查各1项,以及循环检查5项,每项0~4分,总分越高,表示患者的器官功能衰竭越严重,预后越差[5];②根据国际脓毒症诊断标准将脓毒症病情严重程度分为一般脓毒症(对于感染或疑似感染的患者,当SOFA评分较基线上升≥2 分时可诊断为脓毒症)、严重脓毒症(脓毒症同时存在脓毒症引起的组织低灌注或脏器功能障碍)和脓毒性休克[在脓毒症的基础上,出现持续性低血压,在充分容量复苏后仍需血管活性药来维持平均动脉压(MAP)≥65 mmHg 以及血清乳酸浓度>2 mmol/L][6]。
1.4 统计学方法
采用SPSS 18.0统计学软件对数据进行分析,计量资料以均数±标准差(.jpg) ±s)表示,采用t检验,计数资料以率(%)表示,采用χ2检验,等级资料采用秩和检验,危险因素分析采用多因素Logistic回归分析法,以P<0.05 为差异有统计学意义。
±s)表示,采用t检验,计数资料以率(%)表示,采用χ2检验,等级资料采用秩和检验,危险因素分析采用多因素Logistic回归分析法,以P<0.05 为差异有统计学意义。
2 结果
2.1 两组患者临床资料的比较
两组患者的性别、年龄、营养不良情况比较,差异无统计学意义(P>0.05);渗漏组患者的PCT、CRP、Ang2、Tie2、空腹血糖、血清乳酸水平及SOFA评分高于非渗漏组,Ang1 水平低于非渗漏组,凝血功能障碍及MODS 累及脏器≥3个的发生率高于非渗漏组,脓毒症严重程度重于非渗漏组,差异均有统计学意义(P<0.05)(表1)。
2.2 脓毒症患者并发毛细血管渗漏综合征的危险因素分析
以相关临床指标为自变量,以并发毛细血管渗漏综合征为因变量,经多因素Logistic回归分析显示,Ang1 水平下降、Ang2及Tie2 受体水平升高、高血清乳酸水平、高SOFA评分、脓毒症病情严重、MODS 累及脏器≥3个均是脓毒症患者并发毛细血管渗漏综合征的危险因素(P<0.05)(表2)。
表1 两组患者临床资料的比较(.jpg) ±s)
±s)
.jpg)
表2 脓毒症患者并发毛细血管渗漏综合征的危险因素分析
3 讨论
研究表明,毛细血管渗漏综合征是脓毒症患者的常见并发症,也是导致脓毒症患者器官功能不全,影响患者病情恢复的重要危险因素[7-8]。因此,积极探究脓毒症患者发生毛细血管渗漏综合征的危险因素,以便早期预防和及时干预该并发症,对改善脓毒症患者预后具有重要意义。
目前临床学者多认为[9-10],脓毒症并发毛细血管渗漏综合征主要由感染引起全身炎症反应,导致毛细血管内皮细胞收缩、损伤,细胞连接处出现裂隙及分离后血液中小分子蛋白渗漏到组织间隙所导致,可通过静脉滴注清蛋白后测定细胞外液菊粉分布容量和进行生物电阻抗分析来诊断毛细血管渗漏综合征,具有安全、无创的优点,但是价格昂贵,不适合临床广泛应用。鉴于此,本研究分析了脓毒症并发毛细血管渗漏综合征的危险因素,旨在为临床工作者早期诊断和防治脓毒症并发毛细血管渗漏综合征提供参考。本研究中,有13例脓毒症患者并发毛细血管渗漏综合征,脓毒症患者并发毛细血管渗漏综合征的发生率为13%,与国内其他学者报道的7%~16%基本一致[11-12]。另外本研究结果显示,Ang1 水平下降、Ang2及Tie2受体水平升高、高血清乳酸水平、高SOFA评分、脓毒症病情严重、MODS 累及脏器≥3个均是脓毒症患者并发毛细血管渗漏综合征的危险因素(P<0.05)。考虑是因为血清乳酸水平可准确地反映患者组织灌注不足程度和缺氧代谢状态,而脓毒症患者往往伴有组织灌注不良和缺氧的情况,且此种情况又可进一步引起患者的全身性炎症反应,导致患者发生毛细血管渗漏综合征,因此当脓毒症患者并发毛细血管渗漏综合征时,可见其血清乳酸水平升高[13-14]。此外,严重脓毒症和器官功能衰竭患者的全身性炎症反应也更为剧烈,尤其是当患者发生休克时,更可因血管内皮细胞皱缩受损、细胞间距增加导致大分子物质渗出毛细血管而引发毛细血管渗漏综合征,因此当脓毒症患者并发毛细血管渗漏综合征时,其病情严重程度、MODS 累及脏器数量、SOFA评分也相对更高。同时,Ang1 可与Tie2结合而减轻血管炎症和血管渗漏,稳定内皮细胞。而Ang2则可与Ang1 竞争结合Tie2,破坏内皮细胞完整性,并可通过易位到内皮细胞表面来促进白细胞黏附于内皮细胞,促进炎症的发生,以及通过抑制Tie2 受体磷酸化和PI3K/AKT 信号通路而引起细胞间隙的形成和细胞凋亡[15],因此,当脓毒症患者并发毛细血管渗漏综合征时,可见其血清Ang1 水平降低以及Ang2、Tie2 水平升高。
综上所述,脓毒症并发毛细血管渗漏综合征的危害较大,临床工作者需密切监测患者的血清乳酸、Ang1、Ang2及Tie2 水平,并做好对患者病情的评估,以便早期发现,及时治疗。
[参考文献]
[1]梅华鲜,李永胜,陈正平,等.毛细血管渗漏指数在脓毒症并ARDS 早期诊断中的应用[J].新医学,2016,47(10):681-685.
[2]马焕先,史宪杰,粱雨荣,等.脓毒症合并全身性毛细血管渗漏综合征的诊疗分析[J].中华外科杂志,2017,55(9):702-707.
[3]张海洋,乔丽娜.儿童脓毒症并发毛细血管渗漏综合征50例临床特点分析[J].中国现代药物应用,2019,13(4):45-46.
[4]薄禄龙,卞金俊,邓小明,等.2016年脓毒症最新定义与诊断标准:回归本质重新出发[J].中华麻醉学杂志,2016,36(3):259-262.
[5]陈晓燕,李元海,汪正光,等.中文版的简化SOFA评分与qSOFA评分在脓毒症患者筛查中的价值比较研究[J].中国急救医学,2019,39(6):555-558.
[6]方成志,彭凯伟.新生儿毛细血管渗漏综合征的实践[J].中华实用儿科临床杂志,2019,34(14):1041-1043.
[7]盛丽娟,赵海燕,丁悦,等.危重症新生儿毛细血管渗漏综合征的临床流行病学调查[J].中国小儿急救医学,2017,24(1):65-68.
[8]盛丽娟,黄为民.新生儿毛细血管渗漏综合征的早期预测与药物治疗[J].中国儿童保健杂志,2017,25(2):158-160.
[9]陈源美,张琪.毛细血管渗漏综合征发病机制的研究进展[J].中国小儿急救医学,2019,26(6):461-465.
[10]赵倩,谢月群,张涛,等.降钙素原对脓毒症患者病情及预后的临床价值[J].中华急诊医学杂志,2016,25(7):937-943.
[11]张越新,张玲,郭贤庆,等.PCT CRP 血乳酸APACHE ⅡSOFA评分在脓毒症患者疾病严重程度及预后评估中的价值研究[J].中国急救医学,2017,37(12):1109-1114.
[12]查君敬,方长太,白兆青,等.白细胞介素35、降钙素原及SOFA评分对脓毒症病情严重程度及预后的评判价值[J].重庆医学,2019,48(9):1535-1538.
[13]陈茜茜,陈芳.脓毒症并发毛细血管渗漏综合征的危险因素分析[J].中国全科医学,2016,19(36):4504-4508.
[14]吉春玲,周厚荣,杨秀林,等.促血管生成素-2 在脓毒症合并ARDS 患者中的作用[J].中国中西医结合急救杂志,2018,25(4):342-345.
[15]张艺森,徐晓涵,孙炳伟,等.脓毒症时血管内皮细胞与血管平滑肌细胞相互作用的研究进展[J].中华危重病急救医学,2016,23(2):180-183.
Analysis of risk factors for the occurrence of capillary leak syndrome in patients with sepsis
YANG Wen-tao LIN Leng CHEN Ning
Department of Internal Medicine, Fujian Provincial Jinshan Hospital, Fuzhou 350028, China
Department of Internal Medicine, Fujian Provincial Jinshan Hospital, Fuzhou 350028, China
[Abstract]Objective To study the risk factors for the occurrence of capillary leak syndrome in patients with sepsis.Methods A total of 100 patients with sepsis treated in our hospital from October 2017 to September 2018 were selected as the subjects.According to whether suffering from the complication of capillary leak syndrome, the patients were divided into the leakage group (n=13, with the complication of capillary leak syndrome) and non-leakage group (n=87,without complication of capillary leak syndrome).The clinical data of the two groups were compared and analyzed.The risk factors of capillary leak syndrome in patients with sepsis were also analyzed.Results For patients in the leakage group, the levels of procalcitonin (PCT), C-reactive protein (CRP), angiopoietin-2 (Ang2), angiopoietin receptor 2 antibody (Tie2), fasting blood glucose and lactic acid, and the score of sepsis-related organ failure assessment (SOFA) were higher than those of the non-leakage group, and the angiopoietin-1 (Ang1) level was lower than that of the non-leakage group, the incidence of coagulation disorders and multiple organ dysfunction syndrome (MODS) involved with three organs or more was higher than that of non-leakage group, and the state of sepsis was more serious than that of the non-leakage group, the differences were statistically significant (P<0.05).Logistic multivariate analysis showed that the level of Ang1 decreased (β=0.363, OR=1.247, 95%CI [1.121, 1.697]), the levels of Ang2 (β=0.964, OR=1.356, 95%CI[1.135, 1.896]) and Tie2 receptor increased [β=0.891, OR=1.289, 95%CI [1.127, 1.731]), high lactic acid level (β=0.569, OR=1.256, 95%CI [1.112, 1.863]), high SOFA score (β=0.921, OR=1.264, 95%CI [1.125, 1.896]), the state of sepsis was severe [β=0.634, OR=1.446, 95%CI [1.141,1.934]), the organs involved by MODS was three or more(β=0.697, OR=1.446, 95%CI [1.256, 1.943]) were risk factors for the occurrence of capillary leak syndrome in patients with sepsis (P<0.05).Conclusion The decreased Ang1 level, and elevated Ang2 and Tie2 receptor levels, high level of serum lactate, high score of SOFA, severe sepsis, three or more organs involved by MODS are all the risk factor for the occurrence of capillary leak syndrome in patients with sepsis.
[Key words]Sepsis; Capillary leak syndrome; Risk factors; Lactic acid; Angiopoietin-1; Angiopoietin-2; Angiopoietin receptor 2 antibody
[中图分类号]R654.1
[文献标识码]A
[文章编号]1674-4721(2020)3(b)-0026-04
[基金项目]福建省卫生计生委青年科研课题(2017/2/16)
[作者简介]杨文韬(1982-),男,福建邵武人,硕士,副主任医师,研究方向:脓毒症发病机制
(收稿日期:2019-08-12 本文编辑:闫 佩)