急性胰腺炎患者血清淀粉酶、脂肪酶与C反应蛋白水平的变化及临床意义
梁健夫 谢晓婷
广东省阳江市阳东区人民医院,广东阳江 529500
[摘要]目的 探讨急性胰腺炎(AP)患者血清淀粉酶(AMS)、脂肪酶(LPS)与C反应蛋白(CRP)水平的变化及临床意义。方法 选取2015年3月~2018年7月我院收治的997例PA 患者作为AP组,其中835例为轻型,162例为重型,选择同期于我院进行健康体检的1000例健康体检者作为健康组,检测两组的血清AMS、LPS及CRP 水平并进行比较分析。结果 AP组的血清AMS、LPS、CRP 水平均高于健康组,差异有统计学意义(P<0.05);轻型、重型患者的血清AMS、LPS、CRP 水平均高于健康组,差异有统计学意义(P<0.05);重型患者的血清AMS、LPS、CRP 水平均高于轻型患者,差异有统计学意义(P<0.05)。结论 AP 患者AMS、LPS及CRP 水平均存在升高现象,临床可将AMS、LPS及CRP 指标作为诊断AP及其严重程度的参考指标。
[关键词]血清淀粉酶;脂肪酶;C反应蛋白;急性胰腺炎
急性胰腺炎(acute pancreatitis,AP)为消化内科常见疾病,随着人们物质生活水平的不断提升,因暴饮、暴食而导致的AP 患者日益增加[1]。AP 临床主要表现为急性腹痛、按压痛、反跳痛等,具有病情严重、发展快、并发症多等特点,特别是重症AP 发病凶猛,具有较高的死亡率(20%~30%)[2]。因AP 临床表现难以与其他急腹症鉴别,给临床诊断与治疗带来了极大阻碍。因此,本研究特选取我院收治的997例AP 患者作为AP组,同时选择在我院进行健康体检的1000例体检者为健康组,对两组进行血清淀粉酶(amylase,AMS)、脂肪酶(lipase,LPS)、C反应蛋白(C-reactive protein,CRP)检测,探究AMS、LPS、CRP 水平在AP患者中的的变化及临床意义,现报道如下。
1 资料与方法
1.1 一般资料
选取2015年3月~2018年7月我院收治的997例AP 患者作为AP组,其中835例为轻型,162例为重型,选择同期于我院进行健康体检的1000例健康体检者作为健康组。AP组中,男557例,女440例;年龄19~67岁,平均(43.10±5.60)岁。健康组中,男583例,女417例;年龄20~66岁,平均(45.00±4.90)岁。两组的一般资料比较,差异无统计学意义(P>0.05),具有可比性。本次研究申报我院医学伦理委员会批准开展。所有患者均对本次研究知情且自愿参与本次研究;健康组经体检部门设立专门的健康咨询窗口进行相关知识宣讲,选取其中意向强烈且自愿参与的体检者。
1.2 纳入及排除标准
1.2.1 纳入标准 ①AP组患者诊断符合中华医学会消化病学分会胰腺疾病学组、中华胰腺病杂志编辑委员会、中华消化杂志编辑委员会制定的《中国急性胰腺炎诊治指南(2013年,上海)》[3]中的相关AP 标准(经典症状:突发、急性、持续性、剧烈上腹部疼痛,常伴随后背放射性疼痛,血胰酶升高);②影像学提示胰腺坏死、脓肿、渗出、囊肿形成等;③年龄≥18周岁。
1.2.2 排除标准 ①合并肝肾功能障碍、糖尿病、心脑血管等疾病;②伴消化道溃疡穿孔、肠梗阻等其他急腹症;③伴循环衰竭患者。
1.3 方法
受检者均提前告知次日需空腹取血,清晨空腹状态下抽取静脉血5 ml,室温静置凝血,离心机3000 r/min离心5 min,取血清进行检测。LPS 采用日立7180 全自动生化分析仪进行酶法检测,使用科方生物技术股份有限公司提供LPS 试剂盒进行检测,使用VITROS公司提供的vitros 350 试剂盒进行测定;CRP 采用日立7180 全自动生化分析仪进行免疫比浊法试验进行测定,使用重庆中元生物技术有限公司提供的CRP试剂盒进行检测,使用Sekisui 公司提供的试剂盒进行测定。AMS 采用罗氏Cobas 8000 全自动生化分析仪进行酶法试验进行测定,使用罗氏公司提供的AMS 试剂盒进行检测,测定操作方法严格按照试剂盒说明书进行。
1.4 观察指标及评价标准
检测两组的血清AMS、LPS及CRP 水平并进行比较分析。AMS 正常参考范围28~100 U/L,LPS 正常参考范围0~60 U/L,CRP 正常参考范围0~10 mg/L,检测所得各项值超出最大范围则判定为阳性。
1.5 统计学方法
采用SPSS 13.0统计学软件进行数据分析,计量资料用均数±标准差(.jpg) ±s)表示,两组间比较采用t检验;计数资料采用率表示,组间比较采用χ2检验,以P<0.05 为差异有统计学意义。
±s)表示,两组间比较采用t检验;计数资料采用率表示,组间比较采用χ2检验,以P<0.05 为差异有统计学意义。
2 结果
AP组的血清AMS、LPS、CRP水平均高于健康组,差异有统计学意义(P<0.05);轻型、重型患者的血清AMS、LPS、CRP 水平均高于健康组,差异有统计学意义(P<0.05);重型患者的血清AMS、LPS、CRP 水平均高于轻型患者,差异有统计学意义(P<0.05)(表1)。
表1 两组血清AMS、LPS、CRP 水平的比较(.jpg) ±s)
±s)
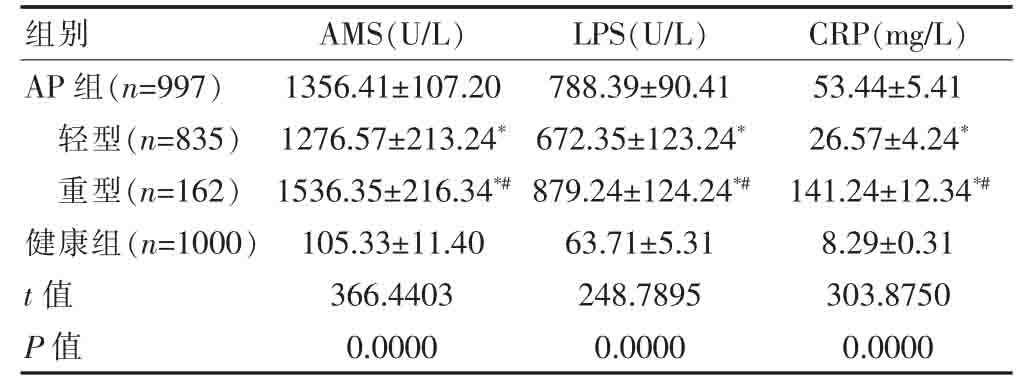
与健康组比较,*P<0.05;与同组轻型比较,#P<0.05
3 讨论
AP的发病机制目前尚未完全明确,相关研究认为AP 系机体在短时间内受多种诱因共同影响而导致的胰酶被异常激活,胰酶持续分泌给胰腺造成持续性损害而发生的全身炎症反应[4]。AP 可由胆道疾病、高脂血症、酒精等病因所致,根据病因可分为胆源性AP、酒精性AP、高脂血症性AP、特发性AP 等。胆源性AP 影像学检查可提示胆总管结石或胆囊结石;酒精性AP 患者往往合并长期大量饮酒史或发病前有大量饮酒行为;高脂血症性AP 患者实验室指标三酰甘油水平明显升高;特发性AP 为经过实验室检查、影像学检查、病史分析后任无法明确病因。AP 具有起病急、发展快、病情凶猛等特点,临床根据患者体征、症状将AP 分为轻型AP 与重型AP。轻型AP 临床表现较轻,无并发症或并发症较少,有自限性,绝大部分患者经过对症治疗后痊愈。但重型AP 病情发展更快,可合并全身多器官功能障碍与损害。重型AP 合并胰腺局部坏死死亡率高达20%~30%,合并胰腺弥漫性坏死死亡率可达50%~80%,伴多器官功能衰竭患者死亡率基本高达100%。因此,对该疾病及早确诊及给予针对性治疗尤为重要[5]。目前针对AP 诊断流程为影像学如X线、CT、MRI 等检查,但影像学检查缺乏一定特异性,如针对胆源性胰腺炎,可以通过超声、CT、MRI 等影像学方式检查发现结石,但针对其他病因导致的AP则缺乏特异性,针对部分早期胰腺炎容易漏诊,且影像学检查对病患会造成一定副作用,针对疾病检查有益有弊[6]。AP 患者因上腹部剧烈疼痛,在进行影像学检查过程中需移动体位及等待检查报告,会导致患者疼痛加剧,降低检查依从性。近些年来,血清标志物水平检测诊断疾病已经成为了疾病诊断确诊的一种重要方法,针对AP 常采用AMS、LPS及CRP 水平检测,具有较好诊断效能。
AMS 为胰腺分泌的一种消化酶,是诊断AP的重要指标,已被多项临床研究证实[7]。血清AMS 一般在AP 发作后2~12 h 内升高,在12~72 h 内达到峰值,后逐渐开始下降,恢复至正常水平一般需要3~5 d。因AMS 并非胰腺唯一分泌组织,如部分胆管疾病、肠道梗阻患者AMS 水平也会增加[8],AP 患者胰腺组织广泛坏死后其AMS 水平反而处于正常水平甚至下降,且AMS 水平在血中半衰期较短,为120~130 min,实验室检测结果容易受其他因素影响而出现误差;另外AMS的代谢受肝、肾功能影响较大,因此临床仅依靠诊断AMS 难以确诊AP。LPS 来源主要系胰腺胰泡细胞,是一种分子量约为48 kDa的氨基酸糖蛋白,其正常水平为血清中2000倍左右,约99%分泌进入胰腺导管,仅有1%由腺泡细胞的基底部分分泌进入其他组织与小肠中,AP 发生、发展过程中会对胰泡造成一定损伤[9],同时,胰腺组织损伤会导致胰管堵塞,大量LPS 通过血液循环进入全身,会导致血清中LPS 含量升高[10]。LPS 一般于发病后4~8 h 开始升高,在12 h达到高峰,其活性维持时间相对于AMS 较长,正常情况下8~14 d后恢复正常,其血清半衰期为6.9~13.7 h。且LPS 代谢受肝肾功能影响较小,相对于AMS 指标无法反映AP 病理过程LPS 指标是一个良好的补充[11]。血清CRP是一个主要反映机体是否处于急性期的指标,其具有测定方法简单便捷、价格低廉、应用范围广等特点,受到临床广泛应用。AP 发生、发展过程中,CRP 水平会表现为上升趋势,对于判断胰腺细胞损坏坏死(胰腺炎轻重程度)有良好判断价值[12]。其临床机制为CRP 诱发内皮表达血管内皮黏附因子21、单核细胞趋化蛋白21、细胞黏附因子12,对血管内皮有明显的促炎效果[13]。
本研究结果显示,AP组的血清AMS、LPS及CRP水平均高于健康组,差异有统计学意义(P<0.05),提示AP 患者AMS、LPS及CRP 水平较正常水平均存在升高现象,临床可将其作为诊断AP及其严重程度的参考指标。李溪等[14]联合AMS、LPS及CRP 检测AP,其研究结果与本次研究结果大致相仿。吴松等[15]联合AMS、LPS及降钙素原检测诊断AP 发现具有较高敏感性与特异性,且其还能够对临床治疗效果及预后起到预测效果。本次研究为大样本量研究,但并未对AP患者进行轻度、中重度进行区分,对联合AMS、LPS及CRP 检测是否能够为临床区分AP 病情程度未进行相关探讨,后期可针对此方面进行进一步研究,补充相关研究成果;另还可以针对AP 患者治疗过程中AMS、LPS、CRP 水平变化与病情发展是否存在影响进行补充研究。
综上所述,AP 患者AMS、LPS及CRP 水平均存在升高现象,临床可将AMS、LPS及CRP 指标作为诊断AP及其严重程度的参考指标。
[参考文献]
[1]Filik L.Impact of pancreatitis on survival for pancreatic cancer[J].Pancreatology,2019,19(2):397.
[2]Tomescu D,Popescu MH,David C,et al.Clinical effects of hemoadsorption with CytoSorb R in patients with severe acute pancreatitis:A case series[J].Int J Artif Organs,2019,42(4):190-193.
[3]中华医学会消化病学分会胰腺疾病学组,中华胰腺病杂志编辑委员会,中华消化杂志编辑委员会.中国急性胰腺炎诊治指南(2013年,上海)[J].临床肝胆病杂志,2013,29(9):656-660.
[4]Huang Y,Xiao J,Cai T,et al.Immature granulocytes:A novel biomarker of acute respiratory distress syndrome in patients with acute pancreatitis[J].J Crit Care,2019,50:303-308.
[5]张凌志,李凯江.急性胰腺炎86例的临床分析[J].河南外科学杂志,2018,24(5):34-35.
[6]周波,戴飞跃,翁国虎.急性胰腺炎的诊疗进展[J].现代中西医结合杂志,2015,24(5):565-567.
[7]罗善明,艾霞,林丽立,等.丹参注射液联合杂合式血液净化疗法对重症急性胰腺炎患者血清血小板活化因子、淀粉酶水平的影响[J].临床和实验医学杂志,2019,18(4):413-417.
[8]Inoue H,Uemura S,Harada K,et al.Risk factors for acute pancreatitis in patients with accidental hypothermia[J].Am J Emerg Med,2019,37(2):189-193.
[9]陈静,吴婷.血清脂肪酶对急性胰腺炎的诊断价值探讨[J].医学理论与实践,2019,32(6):794-797.
[10]曹友德,陈玮,李浩.急性胰腺炎患者脂肪酶的检测与临床意义[J].中国现代医学杂志,2001,11(6):90-91.
[11]姚丽娜,顾建文,史伟峰.淀粉酶、脂肪酶联检对提高急性胰腺炎诊断的临床价值分析[J].临床医药文献电子杂志,2017,4(97):19 031-19 032.
[12]许楠.生化检测指标在急性胰腺炎诊断中的临床价值[J].中国当代医药,2018,25(30):125-127.
[13]高之峰,王义秋,邢飞,等.血清C-反应蛋白/白蛋白比值对急性胰腺炎患者预后的预测作用[J].徐州医科大学学报,2018,38(9):571-574.
[14]李溪,周迎春.血清淀粉酶、C反应蛋白、白细胞联合检测对急性胰腺炎鉴别的价值研究[J].检验医学与临床,2019,16(02):161-163,167.
[15]吴松,李治君,沈钢.血淀粉酶等联合检测在急性胰腺炎诊断及预后评估中的价值[J].热带医学杂志,2018,18(5):621-624.
Changes and clinical significances of serum amylase, lipase and C-reactive protein levels in patients with acute pancreatitis
LIANG Jian-fu XIE Xiao-ting
People′s Hospital of Yangdong District in Yangjiang City, Guangdong Province, Yangjiang 529500, China
People′s Hospital of Yangdong District in Yangjiang City, Guangdong Province, Yangjiang 529500, China
[Abstract]Objective To investigate the changes and clinical significance of serum amylase (AMS), lipase (LPS) and C-reactive protein (CRP) levels in patients with acute pancreatitis (AP).Methods A total of 997 cases of AP patients admitted to our hospital from March 2015 to July 2018 were selected as the AP group, among them, 835 cases were mild and 162 cases were severe.Altogether 1000 cases of healthy subjects who underwent physical examination in our hospital during the same period were selected as the healthy group.The serum AMS, LPS and CRP levels of the two groups were detected and compared.Results The levels of serum AMS, LPS and CRP in the AP group were higher than those in the healthy group, and the differences were statistically significant (P<0.05).The levels of serum AMS, LPS and CRP of mild and severe patients were higher than those of the healthy group, and the differences were statistically significant (P<0.05).The levels of serum AMS, LPS and CRP of the severe patients were higher than those of the mild patients, and the differences were statistically significant (P<0.05).Conclusion The levels of AMS, LPS and CRP of patients with AP are higher.AMS, LPS and CRP can be used as reference indexes in the diagnosis of AP and its severity.
[Key words]Serum amylase; Lipase; C-reactive protein; Acute pancreatitis
[中图分类号]R446.6
[文献标识码]A
[文章编号]1674-4721(2020)3(b)-0166-03
[作者简介]梁健夫(1978-),男,本科,副主任检验师,研究方向:生化检验
(收稿日期:2019-06-05 本文编辑:任秀兰)