食品大肠菌群间接计数法在水质大肠菌群监测中的应用效果
赵卫红 徐秋琴 裴拥军 毛云斌 黄 曾 邹锦群 詹卓蓬
江西省丰城市疾病预防控制中心检验科,江西丰城 331100
[摘要]目的 探讨GB 4789.3-2016《食品安全国家标准 食品微生物学检验 大肠菌群计数》中的间接计数法(MPN法)检测水质大肠菌群的效果。方法 采集2017年10月~2018年4月丰城市城市生活饮用水、农村生活饮用水、水库水、水源水等各类水质,利用GB 4789.3-2016 中的MPN法与GB/T 5750.12-2006《生活饮用水标准检验方法微生物指标》中的总大肠菌群MPN法检测水质大肠菌群,验证两种方法检测水质大肠菌群的关联性,比较分析两种方法检测每项阳性样本所花费的人力、物力、费用、时间以及大肠菌群阳性率。结果 两种MPN法检测水质大肠菌群的一致性较好(Kappa=0.97);两种MPN法检测水质大肠菌群的阳性率比较,差异无统计学意义(P>0.05);食品大肠菌群MPN法的仪器耗损费、试剂费用、消耗人力费用均低于水质大肠菌群MPN法,消耗时间短于水质大肠菌群MPN法,差异有统计学意义(P<0.05)。结论 食品大肠菌群MPN法可替代水质大肠菌群MPN法用于水质大肠菌群的检测,可大大节省人力、物力、财力。
[关键词]GB 4789.3-2016 间接计数法;GB/T 5750.12-2006 间接计数法;人力消耗;物力消耗;时间消耗
大肠菌群为水质卫生监测的指示菌[1],实现其快 速检测具有重要的卫生学意义。目前,对于大肠菌群快速检测的方法大部分是基于对其核酸的分子生物学检测,这些技术对实验条件的要求高,价格昂贵,因此限制了其应用[2]。目前普遍采用的水质大肠菌群间接计数法(MPN法)较食品大肠菌群MPN法操作步骤多,繁杂,且工作量较大[3]。本研究将食品大肠菌群MPN法用于水质大肠菌群的检测,验证实试验验证大肠菌群的检测效果,对照水质大肠菌群MPN法的检测时间、消耗的人力、物力以及大肠菌群检出率,旨在探讨食品大肠菌群MPN法用于水质大肠菌群检测的应用价值,现报道如下。
1 材料与方法
1.1 样本与试剂
采集2017年10月~2018年4月丰城市城市生活饮用水、农村生活饮用水、水库水、水源水等各类水质,试剂包括:乳糖蛋白胨培养液、革兰染色液、伊红美蓝琼脂、月桂基硫酸盐胰蛋白胨(LST)肉汤、煌绿乳糖胆盐(BGLB)肉汤(青岛高科技园海博生物技术有限公司)。
1.2 仪器与设备
YC-180 澳柯玛冰箱(澳柯玛股份有限公司)、JMA 电子天平(诸暨市超泽衡器设备有限公司)、BSC-1300ⅡA2 生物安全柜(苏州安泰空气技术有限公司)、CJV1500T 洁净工作台(山东新华医疗器械厂)、LMQ.C 立式灭菌器(山东新华医疗器械厂)、5V 电动移液枪(DLAB Scientific Inc)。
1.3 方法
1.3.1 检测前准备 高压灭菌消毒采水容器,将水样本置入容器中,在6 h 内送到检测实验室。
1.3.2 水质大肠菌群检测方法 采用GB/T5750.12-2006《生活饮用水标准检验方法 微生物指标》中的总大肠菌群MPN法。用灭菌吸管取10 ml 水样接种到10 ml 双料乳糖蛋白胨培养液中,用灭菌吸管取1 ml水样接种到10 ml 单料乳糖蛋白胨培养液中,另取1 ml水样加到9 ml 生理盐水中混匀,用1 ml 灭菌吸管注入到10 ml 单料乳糖蛋白胨培养液中,每一稀释度接种5 管,总共15 管。
将接种管置于(36±1)℃培养箱内,培养(24±2)h,如有产酸、产气管,分别转种在伊红美蓝琼脂平板上,于(36±1)℃培养箱内培养18~24 h,符合深紫黑色,有金属光泽;紫黑色带或略带金属光泽;淡紫红色,中心较深的菌落,做革兰染色、镜检、证实实验。计大肠菌群阳性管数,查MPN 表得出大肠菌群最可能数(MPN)值。
1.3.3 食品大肠菌群检测方法 采用GB 4789.3-2016《食品安全国家标准 食品微生物学检验 大肠菌群计数》中的MPN法检测。用灭菌吸管取10 ml 水样接种到10 ml LST 肉汤管培养液中,用灭菌吸管取1 ml 水样接种到10 ml LST 肉汤管培养液中,另取1 ml 水样加到9 ml 生理盐水中混匀,用灭菌吸管取1 ml 水样接种到10 ml LST 肉汤管培养液中,每一稀释度接种3 管,总共9 管。
将接种管置于(36±1)℃培养箱内,培养24~48 h,产气管进行复发酵试验,取培养物1 环,移种于BGLB肉汤管中,(36±1)℃培养(48±12)h,计大肠菌群阳性管数,查MPN 表得出大肠菌群MPN值。
1.3.4 两种方法的一致性检验 采用统计学Kappa 检验验证GB 4789.3-2016 中的MPN法与GB/T 5750.12-2006 中的总大肠菌群MPN法检测水质中大肠菌群的一致性,证明两种方法均能用于水质中大肠菌群的检测。
1.4 观察指标
比较两种方法检测每项阳性样本所花费的人力、物力、费用、时间,评价两种方法大肠菌群的检测效果,并分析两种方法检测的大肠菌群阳性率。
1.5 统计学方法
采用SPSS 17.0统计学软件对数据进行分析,计量资料以均数±标准差(.jpg) ±s)表示,采用t检验,计数资料以率(%)表示,采用χ2检验,以P<0.05 为差异有统计学意义;采用Kappa值检验一致性,Kappa≥0.75提示一致性较好。
±s)表示,采用t检验,计数资料以率(%)表示,采用χ2检验,以P<0.05 为差异有统计学意义;采用Kappa值检验一致性,Kappa≥0.75提示一致性较好。
2.结果
2.1 两种MPN法检测水质大肠菌群的一致性
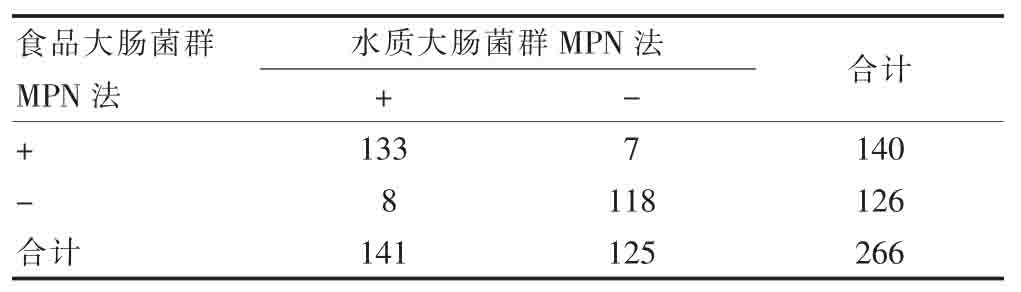
两种MPN法检测水质大肠菌群的一致性较好(Kappa=0.97)(表1)。
表1 两种MPN法检测水质大肠菌群的一致性检验结果(MPN/100 ml)
2.2 两种MPN法检测水质大肠菌群阳性率的比较
两种MPN法检测水质大肠菌群的阳性率比较,差异无统计学意义(P>0.05)(表2)。
表2 两种MPN法检测水质大肠菌群阳性率的比较(MPN/100 ml)

表3 两种MPN法所耗成本的比较(.jpg) ±s)
±s)
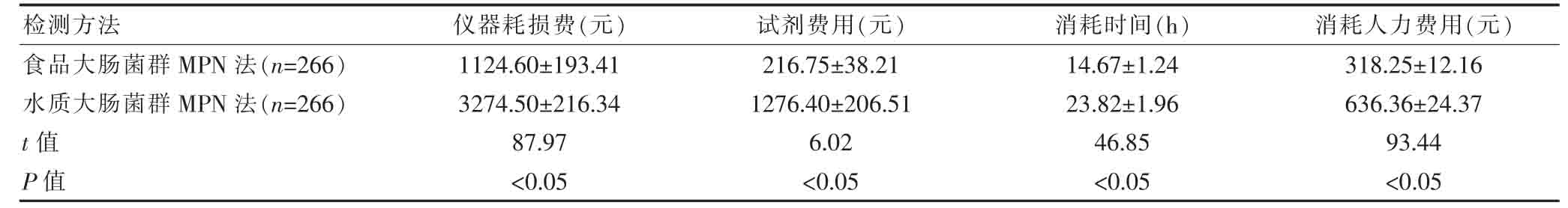
2.3 两种MPN法所耗成本的比较
食品大肠菌群MPN法的仪器耗损费、试剂费用、消耗人力费用均低于水质大肠菌群MPN法,消耗时间短于水质大肠菌群MPN法,差异有统计学意义(P<0.05)(表3)。
3 讨论
大肠菌群是公认的水质卫生监测指示菌[4-5],便利、快速、廉价的检测方法对确保水质的卫生至关重要。目前国内外对于大肠菌群快速检测方法很多,这些方法包括核酸杂交技术、聚合酶链式反应(PCR)及其衍生技术、基于16SrRNA 与GyaB的检测技术[1]、化二硫化钼(MoS2)纳米片的光纤表面等离子体共振免疫传感器快速检测技术[6]、流式细胞阻抗仪检测[7]、组合的单砷化丙啶染色和定量PCR 检测[8]、智能手机的凝胶环介导的等温扩(gLAMP)系统[9]、人类致病菌下一代测序[10]、氯酚的生物降解[11]、生物物传感器蛋白子弹快速检测饮用水中大肠杆菌的荧光方法[12]、快速检测体细胞噬菌体的方法(Bluephage 法)[13]、浓缩和免疫检测法[14]等,这些方法快捷、精确,但需要高精仪器与设备,费用也非常昂贵,不适宜在基层疾控中心应用。
一般水质大肠菌群检测,常规采用国标GB/T 5750.12-2006 中的MPN 检测方法,但此法耗费的人力、物力很高、时间较长。本研究采用食品国标GB 4789.3-2016 中的MPN 检测方法,用于检测水质的大肠菌群,经过两种方法检测大肠菌群的关联性检验,结果显示,两种MPN法检测水质大肠菌群的一致性较好(Kappa=0.97),提示两种方法均能用于大肠菌群的检测,且通过两种方法大肠菌群的检出率对比分析,结果显示,两种MPN法检测水质大肠菌群的阳性率比较,差异无统计学意义(P>0.05)。提示食品大肠菌群MPN法用于水质大肠菌群的检测有一定的可行性。本研究结果还显示,食品大肠菌群MPN法的仪器耗损费、试剂费用、消耗人力费用均低于水质大肠菌群MPN法,消耗时间短于水质大肠菌群MPN法,差异有统计学意义(P<0.05),提示食品大肠菌群MPN法具有较好的经济及时间效益[15]。
综上所述,两种方法检出的大肠菌群阳性率基本一致,而GB/T 5750.12-2006 中的MPN 检测方法需要比食品GB 4789.3-2016 中的MPN 检测方法更多的人力、物力、财力,且操作繁琐,花费的时间较长。因此,基层疾控单位采用食品GB 4789.3-2016 中的MPN法替代GB/T 5750.12-2006 中的MPN法检测水质中的大肠菌群,可以因地制宜、操作方便、节省开支与时间。
[参考文献]
[1]郑循志.生物技术在水质大肠杆菌检测中的应用[J].中国高新技术企业,2016,27(378):90-91.
[2]Yuan Y,Zheng G,Lin M,et al.Detectionof viableEscherichia coliin environmentalwaterusing combined propidium monoazide staining and quantitative PCR[J].Water Res,2018,145:398-407.
[3]陈磊,任丽君,刘杰,等.河南开封地区直饮水微生物检测结果分析[J].公共卫生与预防医学,2017,28(5):99-100.
[4]刘莎,谌志强,杨栋,等.用于水中常见大肠杆菌的LAMP快速检测[C]// 2011年全国环境卫生学术年会论文集.2011.
[5]Zhu L,Torres M,Betancourt WQ,et al.Incidence of fecal indicator and pathogenic bacteria in reclaimed and return flow waters in Arizona USA[J].Environ Res,2018,170:122-127.
[6]Kaushik S,Tiwari UK,Pal SSL,et al.Rapiddetection of Escherichia coliusing fiber optic surface plasmon resonance immunosensor based on biofunctionalized Molybdenum disulfide(MoS2)na[J].Biosens Bioelectron,2019,126:501-509.
[7]Clausen CH,Dimaki M,Bertelsen CV,et al.Bacteria detection and differentiation using impedance flow cytometry[J].Sensors(Basel),2018,18(10):E3496.
[8]Yuan Y,Zheng G,Lin M,et al.Detectionof viableEscherichia coliin environmentalwaterusing combined propidium monoazide staining and quantitative PCR[J].Water Res,2018,145:398-407.
[9]Huang X,Lin X,Urmann K,et al.Smartphone-based in-gel loop-mediated isothermal amplification(gLAMP)system enables rapid coliphage MS2 quantification in environmental waters[J].Environ Sci Technol,2018,52(11):6399-6407.
[10]Ghilamicael AM,Boga HI,Anami SE,et al.Potential human pathogenic bacteria in five hot springs in Eritrea revealed by next generation sequencing[J].PLoS One,2018,13(3):e0194554.
[11]Gallego A,Laurino Soulé J,Napolitano H,et al.Biodegradability of chlorophenols in surface waters from the urban area of buenos aires[J].Bull Environ Contam Toxicol,2018,100(4):541-547.
[12]Gutiérrez-Del-Río I,Marín L,Fernández J,et al.Development of a biosensor protein bullet as a fluorescentmethodfor fastdetectionofEscherichia coliin drinkingwater[J].PLoS One,2018,13(1):e0184277.
[13]Muniesa M,Ballesté E,Imamovic L,et al.Bluephage:a rapidmethodfor thedetectionof somatic coliphages used as indicators of fecal pollution inwater[J].Water Res,2018,128:10-19.
[14]Ezenarro JJ,Uria N,Castillo-Fernández O,et al.Development of an integratedmethodof concentration and immunodetection of bacteria[J].Anal Bioanal Chem,2018,410(1):105-113.
[15]武利平,李晓路,刘聪颖,等.两种方法检测水中总大肠菌群和大肠埃希菌的等效性分析[J].卫生研究,2017,46(5):793-796.
Application effect of food coliform indirect counting method in water quality coliform monitoring
ZHAO Wei-hong XU Qiu-qin PEI Yong-jun MAO Yun-bin HUANG Zeng ZOU Jin-qun ZHAN Zhuo-peng
Department of Clinical Laboratory, Fengcheng Center for Disease Control and Prevention in Jiangxi Province,Fengcheng 331100, China
Department of Clinical Laboratory, Fengcheng Center for Disease Control and Prevention in Jiangxi Province,Fengcheng 331100, China
[Abstract]Objective To explore the effect of indirect counting method (MPN method) in GB 4789.3-2016 "National Food Safety Standard for food microbiology test—Coliforms Count" on detecting coliforms in water.Methods The water samples were inciuded urban drinking water, rural drinking water, reservoir water, and water source from Fengcheng city from October 2017 to April 2018.The coliforms in water were detected by the MPN method in GB 4789.3-2016 and the total coliforms MPN method in GB/T 5750.12-2006 "Standard examination methods for drinking water—Microbilolgical parameters", separately.The correlation between the two methods for detecting coliform bacteria was verified.The manpower, material resources, cost, time and the positive rate of coliform bacteria detected by the two methods were compared.Results The consistency of two MPN methods to detect coliform group in water quality was good(Kappa=0.97).There was no significant difference in the positive rate of coliform detected by two MPN methods (P>0.05).The instrument cost, reagent cost and labor cost of food coliform group MPN method were lower than those of water coliform group MPN method, and the consumption time was shorter than that of water coliform group MPN method, and the differences were statistically significant (P<0.05).Conclusion MPN method of food coliform group can replace MPN method of water coliform group to detect coliform group of water quality, which can greatly save manpower, material and financial resources.
[Key words]GB 4789.3-2016 indirect counting method; GB/T 5750.12-2006 indirect counting method; Labor consumption; Material consumption; Time consumption
[中图分类号]R123.1
[文献标识码]A
[文章编号]1674-4721(2020)3(b)-0159-04
[基金项目]江西省卫生计生委科技计划项目(20196031)
[作者简介]赵卫红(1974-),女,副主任技师,研究方向:环境卫生监测
(收稿日期:2019-07-23 本文编辑:闫 佩)