八种医院中药制剂微生物限度检查方法的研究
谢锴标1 陈震尧1 邱新华2▲ 谢德秋2 陈海阳2
1.广东省肇庆市中医院药剂科,广东肇庆 526020;2.肇庆医学高等专科学校药学系,广东肇庆 526020
[摘要]目的 建立皮痒宁洗剂、参榆结肠康灌肠液、痔瘘宝洗剂、妇炎宁洗剂、钩蝉头痛宁胶囊、伤科祛瘀片、舒肝行气胶囊、壮腰健步丸等八种含抑菌成分的医院中药制剂微生物限度检查方法。方法 根据2015 版《中国药典》第四部“1105、1106、1107”项下方法,以八种包含抑菌成分的中药制剂为研究对象,分别选取3 个批次实施微生物限度检测。结果 微生物计数方法适用性试验结果提示,采用稀释法消除抑菌活性,可以采用平皿法测定,亦可采用薄膜过滤法进行微生物计数,两者微生物计数回收比值均在0.5~2.0。控制菌检查适用性试验结果提示,经过稀释处理抑菌成分,结果均为阳性。结论 建立的方法准确可行,可用于八种医院中药制剂微生物限度检查。
[关键词]中药制剂;微生物限度检查;抑菌;方法验证;2015 版《中国药典》
中药制剂为包含多种物质的复合制剂,不管是何种物质具备抑菌效果[1],都能够影响到微生物限度检查的精确性,所以对中药制剂进行微生物限度检查时需首先检测方法的适用性,才能保证检查方法的完整性和准确性。本文八种中药制剂为特色制剂,其微生物限度检查法在各级药品标准中均无收载。依据2015 版《中国药典》第四部要求,建立了微生物限度检查法并进行了验证,能客观地反映药物中微生物的污染状况,达到有效、可控的检测目的。
与2010 版《中国药典》相比,2015 版《中国药典》中对微生物限度检查进行了较大的修订[2-3],培养基更改为广谱性的胰酪大豆琼脂和沙氏葡萄糖琼脂,微生物计数改为需氧菌总数、霉菌和酵母菌总数,对回收试验等要求和内容也进行了对应的修订,方法更倾向于与国际接轨。本文针对含有抑菌成分的中药制剂,采用平皿法和薄膜过滤法两种方法去验证,平皿法具有简单、经济的特点;薄膜过滤法具有准确性高,重复性好的特点[4]。通过比较两种方法,开展研究与验证,对该类药物微生物限度检查方法制定有一定参考和借鉴意义,现报道如下。
1 仪器与试药
1.1 仪器
YXQWF32-500 卧式榘形压力蒸气消毒器(湖南衡阳医疗器械厂);BHC-1300ⅡA-B3 型生物洁净安全柜(苏州净化设备有限公司);SZX 型超净工作台(上海沪南科学仪器联营厂);LRH-250A 生化培养箱(韶关市泰宏医疗器械有限公司);CX31 生物显微镜(奥林巴斯);MJ-160B-Ⅱ霉菌培养箱(上海跃进医疗器械厂);HTY HOMO761 匀浆仪(浙江泰林生物技术股份有限公);420-A 型电热恒温水浴箱(姜堰市新康医疗器械有限公司);JA2003N 电子天平(上海精密科学仪器有限公司);JC101 型电热鼓风干燥箱(上海成顺仪器仪表有限公司、南通嘉程仪器有限公司合作出品)。
1.2 供试品
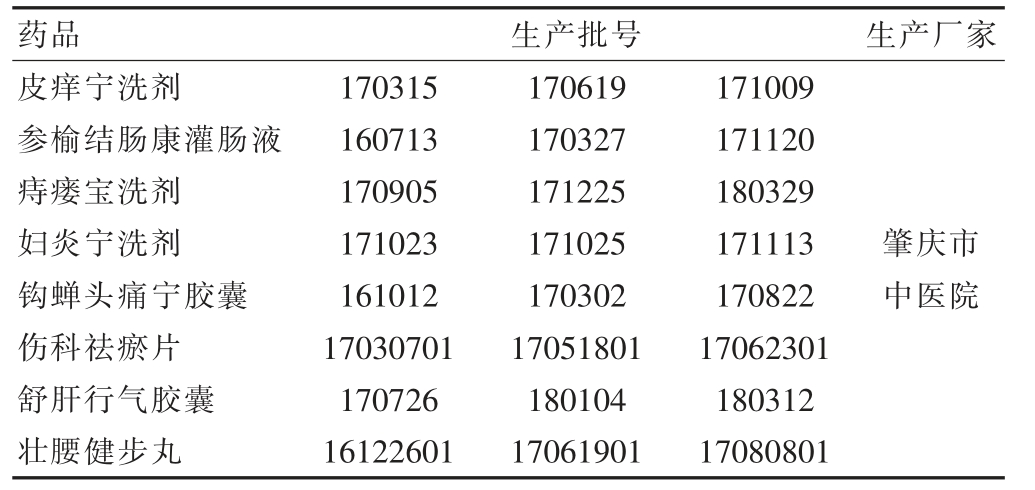
皮痒宁洗剂、参榆结肠康灌肠液、痔瘘宝洗剂、妇炎宁洗剂、钩蝉头痛宁胶囊、伤科祛瘀片、舒肝行气胶囊、壮腰健步丸的批号信息详见表1。
表1 八个中药制剂的生产信息
1.3 菌种
实验中运用到的菌株其传代次数不可大于5 代[5],且使用科学的方式进行保存[6],以保证菌株良好是生物学特点。
金黄色葡萄球菌(staphylococcus aureus)[CMCC(B)26003]、枯草芽 孢 杆 菌(bacillus subtilis)[CMCC(B)63501]、生 孢 梭 菌(clostridumsporogens)[CMCC(F)64941]、铜绿假单胞菌(pseudomonas aeruginosa)[CMCC(B)10104]、白色念珠菌(candida albicans)[CMCC(F)98001]、黑曲霉(aspergillus niger)[CMCC(F)98003]、大肠埃希菌(Escherichia coli)[CMCC(B)44102]、乙型副伤寒沙门菌(salmonella paratyphi B)[CMCC(B)50094]。以上菌种均来自于中国食品药品检定研究院。
1.4 培养基及试剂
胰酪大豆胨琼脂培养基(批号:3106021)、胰酪大豆胨液体培养基(批号:1074651)、沙氏葡萄糖琼脂培养基(批号:1064381)、沙氏葡萄糖液体培养基(3105054)、麦康凯琼脂培养基(批号:1064721)、麦康凯液体培养基(批号:3106271)、溴化十六烷基三甲铵琼脂培养基(批号:3104915)、甘露醇氯化钠琼脂培养基(批号:3105002)、梭菌增菌培养基(批号:3104496)、哥伦比亚琼脂培养基(批号:3104758)、RV 沙门增菌液体培养基(批号:3104847)、木糖赖氨酸脱氧胆酸盐琼脂培养基(批号:1074121)、肠道菌增菌液体培养基(批号:3105454)、紫红胆盐葡萄糖琼脂培养基(批号:3104750)、念珠菌显色培养基(批号:3104798)、三糖铁琼脂培养基(批号:3105052)、硫乙醇酸盐流体培养基(批号:3105365)、pH 7.0 氯化钠-蛋白胨缓冲液(批号:3105256) 均产自广东环凯微生物科技有限公司;聚山梨酯80(批号:20141022),产自天津市富宇精细化工有限公司;二盐酸N,N-二甲基对苯二胺(批号:1604005),产自阿拉丁试剂(上海)有限公司;氯化钠(批号:20160202-2)、过氧化氢(批号:920150701-1)、丙三醇(批号:20160201-1),产自广州化学试剂厂。
本研究所用到的培养基均按使用说明配制及消毒,所用试剂也要按需经过121℃,30 min 蒸汽灭菌[7]。
2 方法与结果
参照2015 《中国药典》版四部“1105、1106、1107”微生物限度检查法[8]进行验证。
2.1 供试品溶液的制备方法设计
2.1.1 不含药材原粉的胶囊剂供试品制备
钩蝉头痛宁胶囊、舒肝行气胶囊,分别称取10 g,用匀浆仪打碎,加入100 ml 胰酪大豆胨液体培养基,慢慢摇至均匀,制成1∶10 供试品,再用胰酪大豆胨液体培养基作为稀释液,配制1∶100 供试品[9]。
2.1.2 含药材原粉的固体制剂制备
伤科祛瘀片、壮腰健步丸,分别称取10 g,加入100 ml 胰酪大豆胨液体培养基, 用匀浆仪制成1∶10供试品, 再用胰酪大豆胨液体培养基作为稀释液,配制1∶100 供试品[10]。
2.1.3 外用液体供试品制备
皮痒宁洗剂、参榆结肠康灌肠液、痔瘘宝洗剂、妇炎宁洗剂,各取一瓶摇匀,作为供试品,再各取10 ml,以胰酪大豆胨液体培养基作为稀释液, 分别制成1∶2供试品、1∶5 供试品、1∶10 供试品、1∶20 供试品[11]。
2.2 菌液制备
2.2.1 高浓度菌悬液的制备
依次将金黄色葡萄球菌、铜绿假单胞菌、枯草芽孢杆菌、大肠埃希菌、沙门菌的新鲜培养物接种到胰酪大豆胨液体培养基内, 该培养基体积为100 ml,将生孢梭菌接种到硫乙醇酸盐流体培养基内,体积同样为100 ml, 然后置于温度为30~35℃生化培养箱内,连续培养18~24 h; 将白色念珠菌接种至沙氏葡萄糖液体培养基内,体积同样为100 ml,然后置于温度为20~25℃的培养箱内培养2~3 d;依次量取10 ml 的培养物,除生孢梭菌的培养物需使用硫乙醇酸盐流体培养基进行稀释外,其他种类的培养物用0.9%无菌氯化钠溶液稀释,分别取各培养物10 ml,加稀释液90 ml,按10 倍递增稀释级数制成每毫升含菌数为1000~10 000 cfu 的菌悬液。
将黑曲霉培养物接种到沙氏葡萄糖琼脂培养基(SDB)表面,然后置于温度为20~25℃的生化培养箱内,连续培养5~7 d,之后用含0.05%(ml/ml)吐温80的0.9%无菌氯化钠溶液冲洗孢子。然后借助无菌吸管把孢子悬液转移至无菌烧瓶中,用上述冲洗液将悬液稀释成含菌数1000~10 000 cfu/ml 的孢子悬液。
2.2.2 低浓度菌悬液的制备
取“2.2.1”项下制备的各菌悬液,进一步稀释成含菌数小于100 cfu/ml 的菌悬液,用于定性致病菌检查方法及微生物计数法中薄膜过滤法的研究。
2.3 供试品微生物计数方法的设计
2.3.1 平皿法设计
需氧菌总数[12]:固体制剂选用(1∶10,1 ml)供试品和(1∶100,1 ml)供试品,必要时选用(1∶1000,1 ml)和(1∶10 000,1 ml)。
液体制剂选用(原液,1 ml)供试品和(1∶10,1 ml)供试品,必要时选用(1∶20,1 ml)供试品和(1∶50,1 ml)供试品。
霉菌和酵母菌总数:固体制剂选用(1∶10,1 ml)供试品,必要时选用(1∶20,1 ml)供试品。
液体制剂选用(原液,1ml)供试品和(1∶2,1 ml)供试品,必要时选用(1∶5,1 ml)供试品和必要时选用(1∶10,1 ml)供试品。
2.3.2 平皿法回收率的设计
2.3.2.1 试验组 取选用浓度的供试品, 每份100 ml,依次添加“2.2.1”项下金黄色葡萄球菌、铜绿假单胞菌、枯草芽孢杆菌、白色念珠菌、黑曲霉,添加量需小于1 ml。吸取1 ml 移至平皿内,制作2 个平行样,倒入相应的培养基。
2.3.2.2 菌液对照组 取pH 7.0 氯化钠-蛋白胨缓冲液代替“试验组”的供试品,同法制备。
2.3.2.3 供试品对照组 取pH 7.0 氯化钠-蛋白胨缓冲液代替“试验组”的菌悬液,同法制备。
上述相应的培养基及培养温度为:对需氧菌进行统计时需使用胰酪大豆胨琼脂培养基在30~35℃的条件下进行培养;对霉菌于酵母菌进行统计时需使用沙氏葡萄糖琼脂培养基(SDB)在20~25℃的温度中培养。
2.3.3 薄膜过滤法计算微生物回收率的设计
2.3.3.1 试验组 取1∶10 供试液10 ml,抽滤过,选择一定量pH 7.0 氯化钠-蛋白胨缓冲液冲洗滤膜,100 ml/次,于末次冲洗结束之后,加入“2.2.2”的相应菌悬液1 ml,滤过,取出滤膜,平行制备2 张贴膜,分别贴于相应培养基上培养[13]。
2.3.3.2 菌液对照组 按薄膜过滤法,加入“2.2.2”的相应菌悬液1 ml,滤过,取出滤膜,平行制备2 张贴膜,分别贴于相应培养基上培养。
2.3.3.3 供试品对照组 取pH 7.0 的氯化钠-蛋白胨缓冲液代替“试验组”的菌悬液,同法制备。
上述相应的培养基及培养温度为:需氧菌计数所使用到的贴膜贴在胰酪大豆胨琼脂培养基平皿中30~35℃的条件下培养; 霉菌与酵母菌计数所使用到的贴膜贴在沙氏葡萄糖琼脂培养基(SDB)平皿中20~25℃的温度中培养。
2.3.3.4 预实验 采用金黄色葡萄球菌作为试验菌株进行预实验,结果使用200 ml 缓冲液,每次100 ml,八个品种的回收率能达到0.5~2.0, 初步确认使用薄膜过滤法(200 ml)可以消除制剂的抑菌作用。
2.3.4 回收率的计算
各菌株的回收率=(试验组的平均菌落数-供试品对照组的平均菌落数)/菌液对照组的平均菌落数×100%
按照要求,回收率在0.5~2.0 之间,供试品3 个批次中若有1 个超出比值,需用进一步用适宜的方法进行试验。计算各试验菌株回收率,结果见表2。
2.4 控制菌检查方法的设计及验证
根据八种制剂的处方、工艺、剂型等特点,本设计需进行耐胆盐革兰阴性菌、大肠埃希菌、沙门菌、铜绿假单胞菌、金黄色葡萄球菌、梭菌、白色念珠菌等方法适应性研究, 所试验的菌种包含了药典全部致病菌。(注:若阳性对照组没有显示出对应菌株活性,则该浓度下菌株被抑制, 需各组再等量加入稀释液稀释,直到阳性对照组的致病菌菌株被培养出来。)
2.4.1 耐胆盐革兰阴性菌检查验证试验
取2.1 项下1∶10 供试液于20~25℃培养2 h,成为预培养供试液[14]。
供试品对照组: 取10 ml 预培养物供试液加入10 ml 肠道菌增菌液体培养基。
阳性(大肠埃希菌)组:照供试品组配制,再加入“2.2.2”项下大肠埃希菌液1 ml。
阳性(铜绿假单胞菌)组:照供试品组配制,再加入“2.2.2”项下铜绿假单胞菌液1 ml。
阴性组:以胰酪大豆胨液体培养基代替“预培养物”,照供试品组配制,再加入稀释液1 ml。
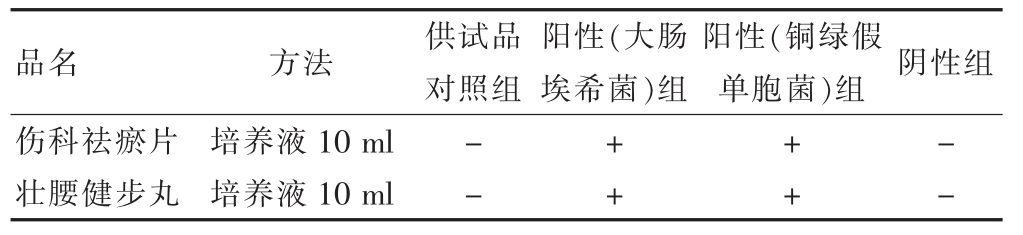
放于30~35℃的生化培养箱内培养24~48 h,之后划线接种在紫红胆盐葡萄糖琼脂培养基的平板中,在同一温度条件的培养箱内进行培养,分析与记录菌落状态。结果见表3。
表2 微生物计数方法适应性验证结果
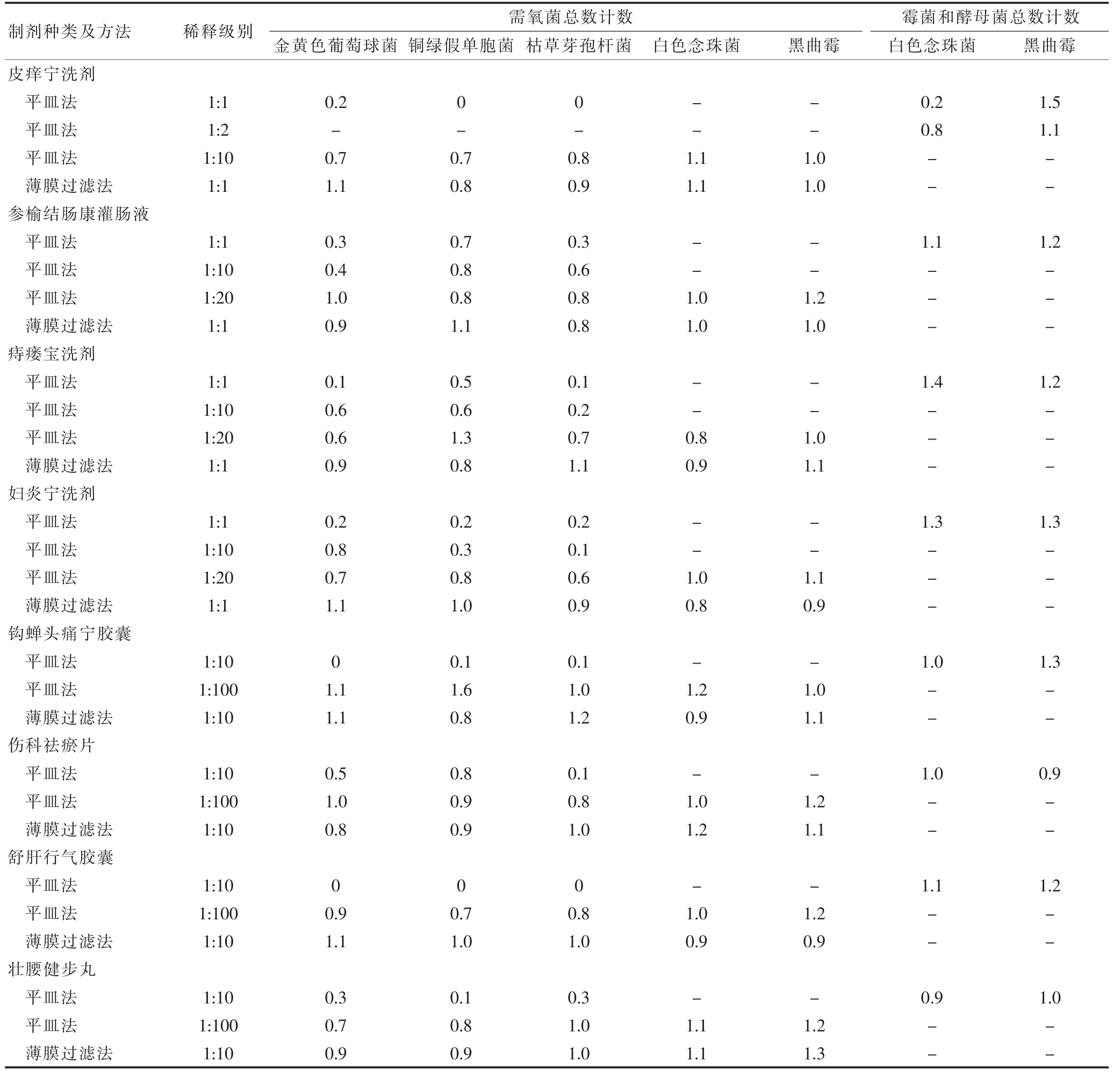
“-”代表无需进行实验
表3 2 品种耐胆盐革兰阴性菌验证结果
2.4.2 大肠埃希菌检查验证试验
供试品对照组:取2.1 项下1∶10 供试液10 ml 加入到100 ml 胰酪大豆胨液体培养基, 再加入稀释液1 ml。
阳性(大肠埃希菌)组:按照供试品组,取“2.2.2”项下大肠埃希菌液1 ml 代替稀释液进行配制。
阴性对照组:按照供试品组,取稀释液10 ml 代替“1∶10 供试液”进行配制。
置30~35℃的生化培养箱中培养18~24 h 后,将其1 ml 添加至100 ml 麦康凯液体培养基上, 放于42~44℃条件下培养24~48 h,之后划线接种在麦康凯琼脂平板中[15],于30~35℃条件下培养18~72 h,并分析与记录菌落状态。结果见表4。
2.4.3 沙门菌检查验证试验
供试品对照组: 取2.1 项下1∶10 供试液100 ml,再加入稀释液1 ml。
阳性(沙门菌)组:按照供试品组,取“2.2.2”项下沙门菌液1 ml 代替稀释液进行配制。
阴性对照组:按照供试品组,取稀释液100 ml 代替“1∶10 供试液”进行配制。
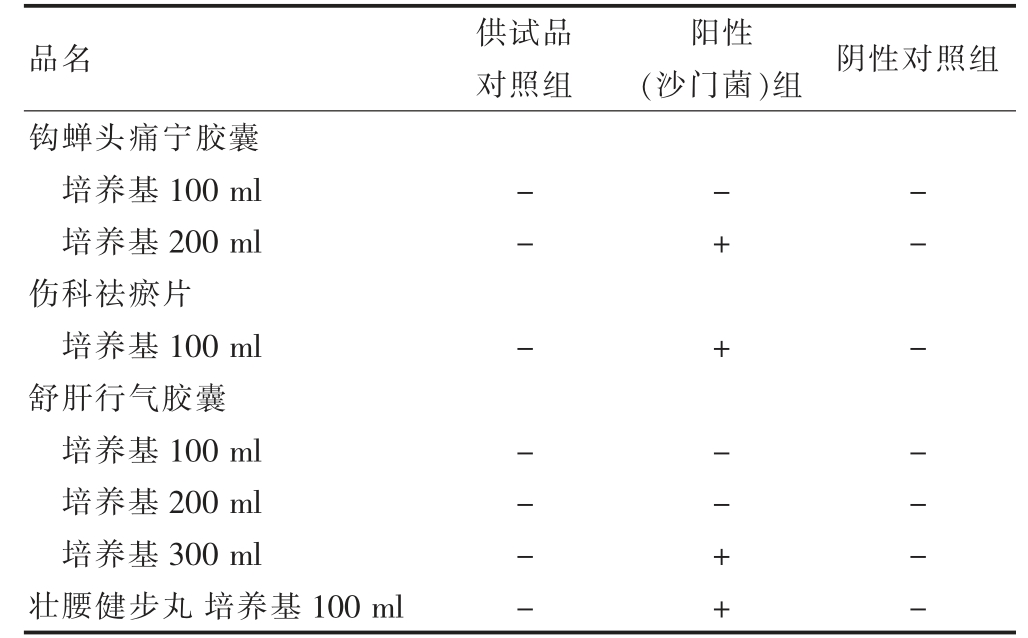
放于30~35℃的生化培养箱内培养18~24 h 之后,将0.1 ml 培养物,接种到10 ml RV 沙门增菌液体培养基上。于30~35℃条件下培养18~24 h,之后划线接种在木糖赖氨酸脱氧胆酸盐琼脂的培养基中。于30~35℃条件下培养18~48 h,借助接种针筛选疑似菌落,并给予斜面与高层穿刺处理,继而接种在三糖铁琼脂培养基中,在30~35℃条件下培养18~24 h,并分析与记录菌落状态[16]。检查沙门菌:钩蝉头痛宁胶囊加入培养基的体积不少于200 ml,舒肝行气胶囊加入培养基的体积不少于300 ml。结果见表5。
表4 4 品种大肠埃希菌验证结果

表5 4 品种沙门菌验证结果
2.4.4 铜绿假单胞菌检查验证试验
供试品对照组: 把2.1 项下1∶10 供试液添加至100 ml 胰酪大豆胨液体培养基内,再加入稀释液1 ml。
阳性(铜绿假单胞菌)组:按照供试品组,取“2.2.2”项下铜绿假单胞菌液1 ml 代替稀释液进行配制。
阴性对照组:按照供试品组,取稀释液10 ml 代替“1∶10 供试液”进行配制。
置30~35℃的生化培养箱中培养18~24 h 后,划线接种至溴化十六烷基三甲铵琼脂培养基平板上,30~35℃培养18~72 h, 后挑疑是菌落做过氧化酶试验, 若培养物30 s 内呈粉红色并逐渐变为紫红色则为氧化酶试验阳性[17]。结果见表6。
2.4.5 金黄色葡萄球菌检查验证试验
供试品对照组:将2.1 项下1∶10 供试液添加至100 ml胰酪大豆胨液体培养基内,之后添加稀释液1 ml。
阳性(金黄色葡萄球菌)组:按照供试品组,取“2.2.2”项下金黄色葡萄球菌液1 ml 代替稀释液进行配制。
表6 4 品种铜绿假单胞菌验证结果
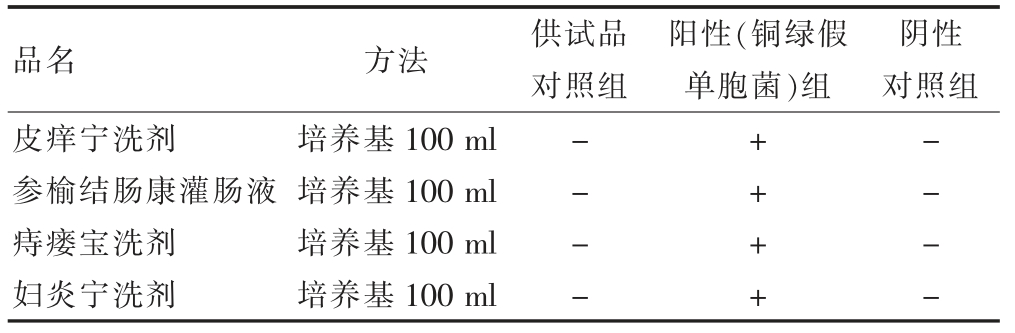
阴性对照组:按照供试品组,取稀释液10 ml 代替“1∶10 供试液”进行配制。
置30~35℃的生化培养箱中培养18~24 h 后,划线接种至甘露醇氯化钠琼脂培养基平板上,30~35℃培养18~72 h,观察菌落形态[18]。结果见表7。
表7 4 品种金黄色葡萄球菌验证结果

2.4.6 梭菌检查验证试验
供试品组:取2.1 项下1∶10 供试液2 份,每份10 ml,其中一份置80℃保温10 min 后冷却。上述2 份供试液各加入1 ml 稀释液并分别接种至100 ml 梭菌增菌培养基中。
阳性对照组:按照供试品组,取“2.2.2”项下梭菌菌液1 ml 代替稀释液进行配制。
阴性(梭菌)组:按照供试品组,取稀释液10 ml代替“1∶10 供试液”进行配制。
置厌氧条件下30~35°C 培养48 h 后, 涂抹接种至哥伦比亚琼脂培养基平板上,厌氧条件下30~35℃培养48~72 h,取疑是菌落滴加3%过氧化氢试液,若菌落表现有气泡产生,则为阳性[19]。
结果提示, 使用100 ml 梭菌增菌培养基, 阳性(梭菌)组即显示出梭菌活性。
2.4.7 白色念珠菌检查验证试验
供试品组:取2.1 项下1∶10 供试液加入到100 ml沙氏葡萄糖液体培养基中,再加入稀释液1 ml。
阳性(白色念珠菌)组:按照供试品组,取“2.2.2”项下白色念珠菌液1 ml 代替稀释液进行配制。
阴性对照组:按照供试品组,取稀释液10 ml 代替“1∶10 供试液”进行配制。
置30~35℃的生化培养箱中培养72~120 h 后,划线接种至沙氏葡萄糖琼脂培养基平板上,30~35℃培养24~48 h, 然后挑选疑是菌落接种至念珠菌显色培养基平板上[20],观察菌落形态。
结果提示,使用100 ml 沙氏葡萄糖液体培养基,阳性(白色念珠菌)组即显示出白色念珠菌活性。
3 讨论
本文中八种医院中药制剂均含有抑菌成分,通过试验,建立了微生物限度检查方法。其中,需氧菌总数计数用平皿稀释法和薄膜过滤法, 霉菌和酵母菌计数:皮痒宁洗剂用1∶2 稀释,参榆结肠康灌肠液、痔瘘宝洗剂、妇炎宁洗剂用原液,钩蝉头痛宁胶囊、伤科祛瘀片、舒肝行气胶囊、壮腰健步丸用1∶10 稀释,回收率在0.5~2.0 之间。由“2.4”的试验可见,八种医院制剂的致病菌检查,除检查沙门菌时,钩蝉头痛宁胶囊稀释液用200 ml, 舒肝行气胶囊的稀释液用300 ml外,其余用常规法,各控制菌均可被检查出来。
2015年版《中国药典》,其修订后的中国药典微生物检验系统与国外完全一致。使原本国内国外有两套微生物检验方法的生产企业, 大大的减少了检验成本。
药典上的致病菌验证没有明确规定要做供试品对照组,本文加入供试品对照组的目的是为了证明供试品没有被污染,更加有力的证明方法可行性。
胶囊剂型或皂苷类成份多的中药制剂,用匀浆仪加液后打碎容易产生泡沫, 对加入的菌种会有影响,可选择打碎后加入稀释液,再搅拌均匀。
微生物试验时,中药胶囊剂常常会遇到胶囊壳不易溶解的情况,为了不影响填充物内的微生物生长,可将打匀后的胶囊液置45℃水浴并时时震摇,使溶解[21]。
本研究建立了皮痒宁洗剂、参榆结肠康灌肠液、痔瘘宝洗剂、妇炎宁洗剂、钩蝉头痛宁胶囊、伤科祛瘀片、舒肝行气胶囊、壮腰健步丸的微生物限度检查,所用菌株涵盖了2015 版《中国药典》的所有试验菌株。试验菌株的稀释浓度会因其活性生物,接种量、生长温度、培养时间、活化代数、个人操作等影响,笔者所探究的所有试验菌株浓度依次为:铜绿假单胞菌8×106 cfu/ml、枯草芽孢杆菌107 cfu/ml、金黄色葡萄球菌5×108 cfu/ml、白色念珠菌7×106 cfu/ml、大肠埃希菌3×108 cfu/ml、 乙型副伤寒沙门菌2×108 cfu/ml、黑曲霉和生孢梭菌可以稀释制备成同浓度多份,孢子悬液保存于2~8℃,在验证贮存期内使用,测定其中1份浓度即可。试验菌株浓度在药典上没有公布,在同类文献中亦少见,现列出培养后的菌株浓度可供同行人员参考。
[参考文献]
[1]康正,刘琳,程春生,等.浅谈中药抗菌作用的研究进展[J].世界最新医学信息文摘,2015,15(99):45.
[2]李趣嫦,江艳芳.《中国药典》2010 版与2015 版微生物限度检查法对四种药物检测结果的比较[J].中国药品标准,2015,16(2):86-90.
[3]杨晓莉,李辉,马英英,等.中国药典2015年版非无菌产品微生物限度检查:微生物计数法解读[J].药物分析杂志,2016,36(6):1101,1107.
[4]陈震尧,谢锴标,姚伟生,等.乌芪舒筋通络片微生物限度检查方法学研究[J].中国当代医药,2017,24(18):93-96
[5]刘广文,苑艳飞.养肝解毒丸微生物限度检查法的验证实验[J].中国医药科学,2016,6(13):54-57.
[6]黄家乐,王玥,何睿,等.制药企业微生物实验室菌种保存方法的探讨[J].中国药事,2017,31(9):1007-1011.
[7]刘茜,姜俊慧,张慧慧,等.药品检验用培养基配制及灭菌后贮存有效期的研究[J].药学研究,2015,34(2):80-83.
[8]国家药典委员会.中国药典[M].一部.北京:中国医药科技出版社,2015:140-151.
[9]田冬梅,史春辉,娄志红,等.药品微生物计数方法及方法适用性探讨[J].评价技术与方法,2017,34,(2):97-103.
[10]庞云娟,樊文研,刘康连,等.药品微生物限度检查方法学验证的研究进展[J].中成药,2017,39(10):2137-2140.
[11]刘素如. 药品微生物计数方法及方法适用性试验探讨[J].中国处方药,2018,16(2):36-37.
[12]马德宁,金桂花,崔铉,等.药品微生物计数方法及方法适 用 性 探 析[J].中 国 卫 生 标 准 管 理,2017,20(8):106-107.
[13]易伟,李思,吴晶晶,等.4 种大黄制剂微生物限度检查方法验证及分析[J].中国药业,2018,27(22):33-37.
[14]李思,易伟,吴晶晶,等.不同中药制剂微生物限度检查方法学的研究[J].中国医药导报,2018,15(27):98-101.
[15]肖甜甜,王明翠,刘洋,等.利胆止痛片微生物限度检查方法的建立[J].中国处方药,2018,16(12):30-31.
[16]王志君,梅莉倩,王晓君,等.六种中药制剂微生物限度检查法适用性研究[J].药学服务临床,2018,21(11):1283-1287.
[17]田怀平,杜毅,李超,等.氧化锌滑石粉洗剂微生物限度检查的方法适用性研究[J].药物评价研究,2017,40(10):1432-1435.
[18]汪琦,李雄英,吴智娟,等.肤宁洗剂微生物限度检查方法的建立及验证[J].浙江中西医结合杂志,2017,27(8):713-716.
[19]杨燕,蒋波,鲍英,等.四种药品微生物快速鉴定技术的方法学一致性评价[J].中国药学杂志,2016,51(22):1967-1971.
[20]李力,杨柳,解小霞,等.妇科洗剂微生物限度检查法的适用性考察[J].中国药师,2018,21(9):1678-1680.
[21]倪玉佳,戈煜,汤露,等.六种中药胶囊剂微生物限度检查方法验证[J].实用药物 与与研究,2018,18(4):300-303.
Study on microbial limit test methods of eight kinds of hospital traditional Chinese medicine preparations
XIE Kai-biao1 CHEN Zhen-yao1 QIU Xin-hua2▲ XIE De-qiu2 CHEN Hai-yang2
1.Department of Pharmacy,Zhaoqing Hospital of Traditional Chinese Medicine,Guangdong Province,Zhaoqing 526020,China; 2. Department of Pharmacy, Zhaoqing Medicine College, Guangdong Province, Zhaoqing 526020, China
1.Department of Pharmacy,Zhaoqing Hospital of Traditional Chinese Medicine,Guangdong Province,Zhaoqing 526020,China; 2. Department of Pharmacy, Zhaoqing Medicine College, Guangdong Province, Zhaoqing 526020, China
[Abstract] Objective To stablish the microbial limit test method for eight hospital Chinese materia medica preparations such as Piyangning Lotion, Shenyu Jiechangkang Enema, Zhiloubao Lotion, Fuyanning Lotion, Gouchan Toutongning Capsules, Shangke Quyu Tablets, Shugan Xingqi Capsules, Zhuangyao Jianbu Pills, etc. which contain antibacterial components. Methods According to the methods mentioned under Part Ⅳ “1105, 1106 and 1107” of Version 2015 Chinese Pharmacopoeia, the 8 Chinese materia medica preparations which contain antibacterial components were taken as the research objects, and 3 batches were selected for implementing the microbial limit test. Results The results of the applicability test of the microbial count method suggest that the antibacterial activity can be eliminated by dilution method, which can be determined by plate method or by membrane filtration method. The recovery ratio of the microbial count of both methods was 0.5-2.0. The results of the suitability test of the control bacteria showed that all the bacteriostatic components were positive after dilution treatment. Conclusion Establishing method is correct and feasible, which could be used for microbial limit test of eight hospital Chinese materia medica preparations.
[Key words] Traditional Chinese medicine preparation; Microbial limit test; Bacteriostasis; Method validation; Version 2015 Chinese Pharmacopoeia
[中图分类号] R917
[文献标识码] A
[文章编号] 1674-4721(2019)3(c)-0007-06
[基金项目]广东省肇庆市科技创新指导类项目(2017040311 09)
[作者简介]谢锴标(1983-),男,广东郁南人,本科,主管中药师,主要从事药品检验工作
▲通讯作者:邱新华(1977-),女,广东四会人,本科,主管药师,肇庆医学高等专科学校药学系,研究方向:药物分析
(收稿日期:2018-01-04本文编辑:孟庆卿)