Keap1/Nrf2/HIF- 1α 通路在宫颈癌中的表达及临床意义研究
彭 辉1 肖仁斌1 王江涛1 文兆明1 周开良1 吴 娟2▲
1.江西省萍乡市湘雅萍矿合作医院肿瘤科,江西萍乡 337000;2.江西省萍乡市卫生职业学院,江西萍乡 337000
[摘要]目的 探讨Keap1/Nrf2/HIF-1α 通路在宫颈癌患者中的表达及临床意义。方法 选择2017年3月~2018年10月江西省萍乡市湘雅萍矿合作医院治疗的40 例宫颈癌患者作为研究对象,所有患者均行手术治疗,术中切除病灶组织及癌旁组织, 获得新鲜标本。采用免疫组织化学法测定获得宫颈癌组织及癌旁组织的低氧诱导因子-1α(HIF-1α)、NF-E2 相关因子2(Nrf2)、Keap1 阳性率。采用反转录-聚合酶链反应(RT-PCR)技术测定Keap1-Nrf2-HIF-lα 基因通路表达量。结果 宫颈癌组织中的HIF-1α、Nrf2、Keap1 阳性率,均高于癌旁组织(P<0.05)。免疫组化下Nrf2 主要表达于宫颈癌细胞核内,部分位于胞质内,而HIF-1α、Keap1 在宫颈癌组织中多表达于细胞胞质内。宫颈癌组织中的Keap1/Nrf2/HIF-1α 基因通路表达量,高于癌旁组织(P<0.05)。 结论Keap1/Nrf2/HIF-1a 通路在宫颈癌中呈表达,可能参与了宫颈癌疾病发生和发展的过程。
[关键词]Keap1/Nrf2/HIF-1α 通路;宫颈癌;免疫组织化学法;RT-PCR 技术
宫颈癌是临床上常见的妇科恶性肿瘤,其病死率在所有妇女癌症死亡率中居于第二位[1]。手术是宫颈癌患者首选治疗方法, 通过手术能切除病灶组织,延缓病情发展,但是由于宫颈癌发病早期临床症状缺乏典型性,多数患者确诊时已经是中、晚期,丧失手术时机[2]。化疗、放疗是手术的补充治疗方法,虽然能改善患者症状,但是患者治疗耐受性较差,会对机体免疫水平产生影响。临床研究表明[3-4]:宫颈癌的发生、发展是一个多因素过程,存在缺氧微环境,尤其是在肿瘤扩增中,缺氧更加利于肿瘤细胞代谢、凋亡抵抗,有助于新生血管的生成、 肿瘤的转移。低氧诱导因子-1α(hypoxia-inducible factor-1α,HIF-1α)是由缺氧诱导的、连接在促红细胞生成素基因缺氧反应元件上的一个核因子; 而目前抗氧化应激信号通路中以Keap1(Kelch -like epichlorohydrin -associated protein 1,Keap1)-NF-E2 相关因子2 (NF-E2 related factor 2,Nrf2)诱导机体的内源性抗氧化应答机制多见,但是在宫颈癌中的表达及临床意义缺乏研究[5-6]。因此,本文采用随机对照方法开展研究, 探讨Keap1/Nrf2/HIF-1α 通路在宫颈癌患者中的表达,现报道如下。
1 资料与方法
1.1 一般资料
选择2017年3月~2018年10月江西省萍乡市湘雅萍矿合作医院治疗的40 例宫颈癌患者作为研究对象,年龄35~76 岁,平均(67.85±5.66)岁;病程1~5 个月,平均(2.35±0.45)个月。病理类型:鳞癌34 例,腺癌6 例。纳入标准:①患者符合宫颈癌临床诊断[7],均经手术病理最终确诊;②患者均行手术治疗,均能耐受手术;③患者能遵医完成相关检查、治疗者。排除标准:①合并精神异常或无法耐受手术治疗者;②术前行放化疗、免疫治疗或其他方法治疗者。选择同期手术患者癌旁5 cm 正常组织作为对照。本研究均得到我院医院伦理委员会批准, 患者及家属均签署知情同意书。
1.2 仪器与试剂
抗人的HIF-1α(28b)单抗及牛抗鼠的二IgG 抗。即用型超敏免疫组化染色试剂盒及显色试剂盒(Vector股份有限公司),兔抗人多克隆β-action(PR-0255)抗体和辣根过氧化物酶标记的羊抗兔二抗(德国罗氏诊断有限公司);RT-PCR 试剂盒和膜(北京中杉金桥生物技术有限公司)。
1.3 方法
1.3.1 HIF-1α、Nrf2、Keap1 阳性率的测定 采用免疫组织化学法测定获得宫颈癌组织及癌旁组织HIF-1α、Nrf2、Keap1 表达。取手术过程中的病灶组织,向不同组织中加入蒸馏水与浓度为30.0%的H2O2,常温下加入内源性酶并进行10 min 灭活,PBS 连续进行3次洗涤。将最终获得的切片放置在0.01 M 枸橼酸盐缓冲液中,加入生理盐水控制溶液使pH 最终为6。电炉加热直到煮沸,间隔5 min 后再次进行煮沸,常温下冷却,采用PBS 完成2 次洗涤,每次洗涤5 min,最后加入5% BSA 封闭液并加入HIF-1α、Nrf2、Keap1 蛋白(稀释浓度为1:100)一抗,一滴。滴加完毕后进行3次PBS 洗涤; 在1 ml 底物中加入HIF-1α、Nrf2、Keap1 蛋白二抗一滴,混合后常温下显色,苏木素复染后封片,倒置显微镜下观察细胞数量, 每份标本测定3 次,取平均值[8-9]。
1.3.2 判断方法 参考奥尔雷德评分标准,分别从细胞的阳性数量(1~4 分)、染色强度(0~12 分)完成免疫组化染色评分,总分16 分,分值越高,阳性率越高[10-11]。
1.3.3 Keap1/Nrf2/HIF-1α 基因通路表达量 采用反转录-聚合酶链反应(Reverse Transcription-Polymerase Chain Reaction,RT-PCR)技术测定Keap1/Nrf2/HIF-1α 基因通路表达量。①设计引物,完成标本组织RNA 的提取,并对获得的标本完成逆转录反应、电泳。②Keap1/Nrf2/HIF-1α 基因测定。采用PCR 完成目的基因的扩增, 以β-actin 基因作为对照, 设定总反应体50 μl(10×Reaction Buffer 5 μl)、dNTP (2.5 μmol/leach)的混合物2 μl、预测引物1(12.5 pmol/μl)、预测引物2(12.5 pmol/μl)、Actin 引物1、Actin 引物2 各1 μl、逆转录反应液3 μl、Taq DNA Polymerase (5 U/μl)1 μl、ddH2O 扩容至50 μl)。③扩增条件的设定。设定反应条件:30℃,10 min;42℃,30 min;99℃,5 min;5℃,5 min,连续进行35 个循环, 最后72℃下完成10 min 延伸,10℃保存。扩增产物取5 μl 在1.2%琼脂糖 (含EB 0.5 ng/ml)上电泳,紫外灯下观察结果观察结果并照相, 吸光度扫描仪扫描后PCR 条带用软件进行定量分析, 每一个基因的表达量用β-actin 内参进行标准化, 结果为基因表达量HIF-lα 对β-actin 内参的比值,以上结果重复3 次,取平均值[12]。
1.4 统计学方法
采用SPSS 18.0 统计学软件进行数据分析, 计量资料用均数±标准差(.jpg) ±s)表示,两组间比较采用t 检验;计数资料采用率表示,组间比较采用χ2 检验,以P<0.05 为差异有统计学意义。
±s)表示,两组间比较采用t 检验;计数资料采用率表示,组间比较采用χ2 检验,以P<0.05 为差异有统计学意义。
2 结果
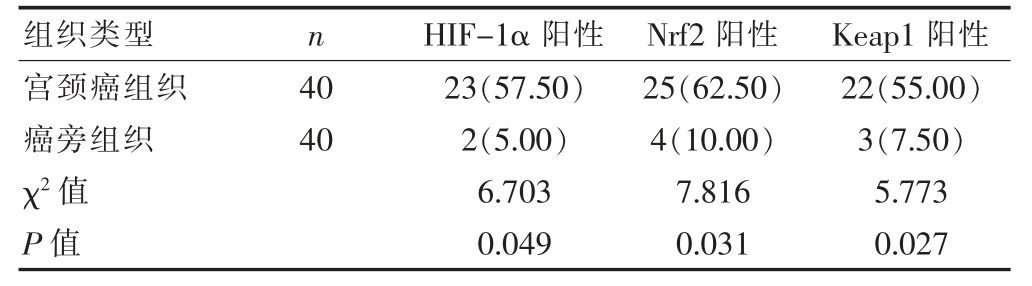
2.1 不同组织中HIF-1α、Nrf2、Keap1 阳性率的比较及宫颈癌组织免疫组化结果
宫颈癌组织中的HIF-1α、Nrf2、Keap1 阳性率,均高于癌旁组织的阳性率(P<0.05)(表1)。
免疫组化下,Nrf2 主要表达于宫颈癌细胞核内,部分位于胞质内;而HIF-1α、Keap1 在宫颈癌组织中多表达于细胞胞质内(图1,见封四)。
表1 不同组织中HIF-1α、Nrf2、Keap1 阳性率的比较[n(%)]
2.2 不同组织中的Keap1/Nrf2/HIF-1α 基因通路表达量情况
宫颈癌组织中的Keap1/Nrf2/HIF-1α 基因通路表达量高于癌旁组织中的表达量(P<0.05)(图2)。
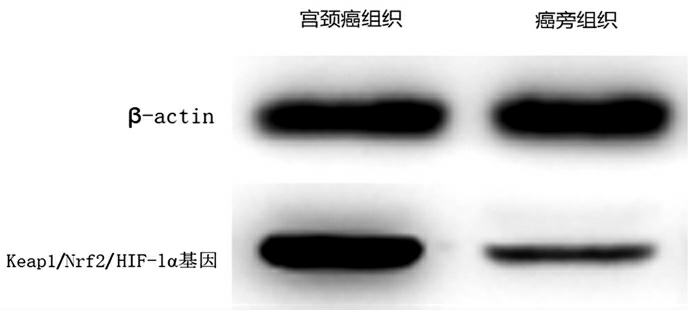
图2 不同组织中的Keap1/Nrf2/HIF-1α 基因通路表达量情况
3 讨论
临床文献报道, 宫颈癌的发生与内源性氧化应激反应或细胞氧化过程中核黄素的转运有关。从大的角度来说, 氧化应激是指机体在受到体内外各种不良因素刺激时,打破体内氧化和抗氧化的平衡,引起体内细胞凋亡或异常增生, 从而诱导某种疾病的发生、发展[13]。
目前,抗氧化应激信号通路中Keap1/Nrf2/HIF-1α通路最为常见。对于正常人而言,Keap1、Nrf2、HIF-1α均位于细胞质中, 且表达水平相对较低或不表达,二者相结合处于稳态。Nrf2 蛋白在泛素蛋白酶体途径介导下降会不断降解,造成Nrf2 表达量较低[14]。但是,当细胞发生致病因素,如:致瘤因素刺激时,HIF-1α、Keap1部分结构将会被修改, 并且与Nrf2 结构部位构象发生改变,持续引起Nrf2 解离,造成信号通路失活[15]。本研究结果提示,宫颈癌组织中的HIF-1α、Nrf2、Keap1阳性率,均高于癌旁组织的阳性率(P<0.05)。免疫组化下Nrf2 主要表达于宫颈癌细胞核内, 部分位于胞质内,而HIF-1α、Keap1 在宫颈癌组织中多表达于细胞胞质内,由此看出HIF-1α、Nrf2、Keap1 在宫颈癌组织中阳性率较高,能参与疾病的发生、发展。HIF-1α在低氧状态下表达水平较高,其基因结构活跃,能迅速对低氧做出反应,HIF-1α 迅速积累,使细胞和机体能够耐受低氧环境,这种对氧浓度变化的迅速的协同的反应,对于机体具有显著的保护意义[16-17]。本研究结果提示,宫颈癌组织中的Keap1/Nrf2/HIF-1α 基因通路表达量,高于癌旁组织的表达量(P<0.05)。临床研究表明,细胞在缺氧条件下产生的HIF-1α 能与靶基因结合,促进靶基因的转录,机理可能为:①能促进红细胞生成素的编码基因[18];②能影响血管内皮生长因子的表达;③能影响血红素加氧酶、诱导型一氧化氮合酶的编码[19];④能促进葡萄糖载体蛋白、糖酵解酶表达水平。因此,临床上可以加强Keap1/Nrf2/HIF-1α 通路水平测定评估患者预后,指导临床治疗[20]。但是,本研究中亦存在诸多不足,一方面,纳入病例数较少,尚需要大样本容量验证;另一方面,进行数据统计处理时存在较大的人为误差,均需要进一步研究与探讨。
综上所述,Keap1/Nrf2/HIF-1α 通路在宫颈癌中呈表达,可能参与了宫颈癌疾病发生和发展的过程。
[参考文献]
[1]胡流芳,王迎,任汝静,等.Keap1-Nrf2/ARE 信号通路的抗氧化应激作用及其调控机制[J].国际药学研究杂志,2016,43(1):146-152.
[2]卢志刚,黄家彬,刘芸,等.醒脑静注射液对急性脑梗死Keap1-Nrf2/ARE 氧化应激通路的影响[J].广东医学,2016,37(20):3127-3129.
[3]Abu-Alainin W,Gana T,Liloglou T,et al.UHRF1 regulation of the Keap1-Nrf2 pathway in pancreatic cancer contributes to oncogenesis[J].J Pathol,2016,238(3):423-433.
[4]马瑶,白雪,李煜,等.混合砷对Keap1 抑制细胞Keap1/Nrf2-ARE 和MAPK/ERK 信号通路的影响[J].环境与职业医学,2017,34(11):999-1003.
[5]黄攀,陆瀚文,周峥嵘,等.Keap1、Nrf2 和HO-1 在大鼠应激性胃溃疡中的表达[J].江苏农业科学,2016,44(12):280-282.
[6]刘理静,钱红,尹辉明,等.中华猕猴桃果仁非饱和脂肪酸通过激活Keap1/Nrf2 信号通路增强肺纤维化大鼠抗氧化能力[J].细胞与分子免疫学杂志,2016,32(4):479-483.
[7]韩伦,赵琳.Nrf2-Keap1 信号通路对肿瘤生物学行为影响的研究进展[J].山东医药,2016,56(36):103-105.
[8]王换换,申正杰,肖航,等.热应激对肝脏中Keap1-Nrf2信号通路及下游基因表达的影响[J].南京农业大学学报,2017,40(1):151-156.
[9]Sun X,Ou Z,Chen R,et al.Activation of the p62-Keap1-NRF2 pathway protects against ferroptosis in hepatocellular carcinoma cells[J].Hepatology,2016,63(1):173-184.
[10]吉琳梅,沈宏春,樊均明.NRF2 通路在慢性肾脏疾病发生发展中的作用研究进展[J].山东医药,2016,56(19):100-102.
[11]黄娟,廖君,彭熙炜,等.脑泰方对脑缺血/再灌注大鼠海马区Nrf2、HO-1 和膜铁转运辅助蛋白表达的影响[J].中国药理学通报,2017,33(10):1467-1472.
[12]王朝阳,荆黎.核转录因子E2 相关因子2 和Keap1 的分子结构和功能及其信号通路调控分子机制研究进展[J].中国药理学与毒理学杂志,2016,30(5):598-604.
[13]Best SA,Souza DPD,Kersbergen A,et al.Synergy between the KEAP1/NRF2 and PI3K pathways drives non-smallcell lung cancer with an altered immune microenvironment[J].Cell Metab,2018,27(4):935.
[14]白美玲,郝秀轻,李峰,等.食管鳞状上皮细胞癌中Keap1、Nrf2 和HO-1 的表达及临床病理意义[J].临床与实验病理学杂志,2016,32(8):914-917.
[15]姬卫秀,何诗依,严露,等.低氧、低氧训练对小鼠骨骼肌Nrf2/Keap1 结合量和p-Nrf2 表达的影响[J].中国体育科技,2017,53(4):114-118.
[16]叶海主,陈亚娟,赵文英,等.肿瘤细胞和耐药肿瘤细胞中FoxO3/Keap1/Nrf2 通路的表达差异[J].中国临床药理学与治疗学,2017,22(8):859-865.
[17]王宇锋,刘旭,陈超,等.6-姜烯酚对结直肠癌细胞中Keap1/Nrf2 通路及下游基因表达的影响[J].宁夏医科大学学报,2017,39(10):1127-1132.
[18]马瑶,白雪,李煜,等.混合砷对Keap1 抑制细胞Keap1/Nrf2-ARE 和MAPK/ERK 信号通路的影响[J].环境与职业医学,2017,34(11):999-1003.
[19]胡流芳,王迎,任汝静,等.Keap1-Nrf2/ARE 信号通路的抗氧化应激作用及其调控机制[J].国际药学研究杂志,2016,43(1):146-152.
[20]王换换,申正杰,肖航,等.热应激对肝脏中Keap1-Nrf2信号通路及下游基因表达的影响[J].南京农业大学学报,2017,40(1):151-156.
Expression and clinical significance study of Keap1/Nrf2/HIF-1α pathway in cervical cancer
PENG Hui1 XIAO Ren-bin1 WANG Jiang-tao1 WEN Zhao-ming1 ZHOU Kai-liang1 WU Juan2▲
1. Department of Oncology, Xiangyaping Mine Cooperative Hospital in Pingxiang City, Jiangxi Province, Pingxiang 337000, China; 2. Pingxiang Health Vocational College of Jiangxi Province, Pingxiang 337000, China
1. Department of Oncology, Xiangyaping Mine Cooperative Hospital in Pingxiang City, Jiangxi Province, Pingxiang 337000, China; 2. Pingxiang Health Vocational College of Jiangxi Province, Pingxiang 337000, China
[Abstract] Objective To explore the expression and clinical significance of Keap1/Nrf2/HIF-1α pathway in cervical cancer. Methods A total of 40 patients with cervical cancer treated in our hospital from March 2017 to October 2018 were selected as subjects in this study. All the patients were treated by surgery. The lesion tissue and adjacent tissues were removed during the operation,and fresh specimens were obtained.The positive rates of hypoxia-inducible factor-1α(HIF-1α), NF-E2 related factor 2 (Nrf2) and Keap1 in cervical cancer tissues and adjacent tissues were determined by immunohistochemistry. The expression of Keap1/Nrf2/HIF-1α gene pathway was determined by RT-PCR. Results The positive rates of HIF-1α, Nrf2 and Keap1 in cervical cancer tissues were higher than those in adjacent tissues (P<0.05). Under immunohistochemistry, Nrf2 was mainly expressed in the nucleus of cervical cancer cells, partially in the cytoplasm; while HIF-1α and Keap1 were mainly expressed in the cytoplasm of cervical cancer tissues. The expression of the Keap1/Nrf2/HIF-1α gene pathway was higher in cervical cancer tissues than that in the adjacent tissues (P<0.05). Conclusion The Keap1/Nrf2/HIF-1α pathway is expressed in cervical cancer and may be involved in the pathogenesis and development of cervical cancer.
[Key words] Keap1/Nrf2/HIF-1α pathway; Cervical cancer; Immunohistochemistry; RT-PCR technology
[中图分类号] R277.733.4
[文献标识码] A
[文章编号] 1674-4721(2019)3(c)-0004-04
[基金项目]江西省萍乡市科技计划(培育类)项目(2017NS058)
▲通讯作者
(收稿日期:2018-11-22 本文编辑:孟庆卿)