糖原合成酶激酶-3与线粒体分裂蛋白在减轻大鼠心肌缺血再灌注损伤作用中的关系
罗维昊1 贺建东2 韩冲芳2▲
1.山西医科大学麻醉学系,山西太原 030001;2.山西医科大学医院麻醉科,山西太原 030001
[摘要]目的探讨糖原合成酶激酶-3(GSK-3β)与线粒体分裂蛋白(Drp-1)在大鼠心肌保护中的关系。方法选取清洁健康雄性SD大鼠60只,体重250~300 g,随机分为4组(n=15):缺血再灌注组(IR组)、缺血再灌注+Mivi-1处理组(M组)、缺血再灌注+SB216763处理组(B组)、缺血再灌注+Mivi-1处理+SB216763处理组(D组)。采用结扎大鼠左冠状动脉前降支30 min,再灌注120 min的方法制备大鼠心肌缺血再灌注(MRIR)模型。M组再灌注前1 min静注 Mivi-1(1.2 mg/kg);B 组再灌注前 1 min静注 SB216763(0.2 mg/kg);D 组再灌注前静注 Mivi-1及 SB216763。腹主动脉取血检测血清肌钙蛋白(cTnI)浓度;取心肌组织,TUNEL法检测细胞凋亡情况,计算凋亡指数(AI);观察心肌病理学结果;Western blot法检测caspase-3表达水平。结果与IR组比较,M、B、D组上述指标下调(P<0.05);与D组比较,M、B组caspase-3浓度、AI、血清cTnI浓度上调,差异均有统计学意义(P<0.05)。结论GSK-3β与Drp-1在大鼠心肌保护作用中并非单一依赖关系。
[关键词]心肌;心肌再灌注损伤;糖原合成酶激酶-3
[中图分类号]R541
[文献标识码]A
[文章编号]1674-4721(2018)6(b)-0012-04
[基金项目]山西省卫生和计划生育委员会科研课题(2015002)
▲通讯作者
The relationship between GSK-3 beta and Drp-1 in alleviating myocardial ischem ia reperfusion injury in rats
LUO Wei-hao1HE Jian-dong2HAN Chong-fang2▲
1.Department of Anesthesiology,Shanxi Medical University,Shanxi Province,Taiyuan 030001,China;2.Department of Anesthesiology,Hospital of Shanxi Medical University,Shanxi Province,Taiyuan 030001,China
1.Department of Anesthesiology,Shanxi Medical University,Shanxi Province,Taiyuan 030001,China;2.Department of Anesthesiology,Hospital of Shanxi Medical University,Shanxi Province,Taiyuan 030001,China
[Abstract]ObjectiveTo investigate the relationship between GSK-3β and Drp-1 in the myocardium protection in rats.Methods60 healthy male SD rats,weighing 250-300 g,randomly divided into 4 groups (n=15):Ischemia reperfusion group(group IR),Ischemia reperfusion+Mivi-1 treatment group(group M),Ischemia reperfusion+SB216763 treatment group(group B),and Ischemia reperfusion+Mivi-1 treatment group+SB216763 treatment group(group D).The myocardial ischemia-reperfusion injury model was established by ligating the LAD for 30 min and reperfusion for 120 min.Mdivi-1(1.2 mg/kg)was given at 1 min before reperfusion in group M by intravenous injection.SB216763(0.2 mg/kg)was given at 1 min before reperfusion in group B by intravenous injection.Both of them were given at 1 min before reperfusion in group D by intravenous injection.cTnI concentration was detected from abdominal aorta blood.Myocardial specimens were obtained from the apex for determination of the AI by TUNEL.Myocardial pathology were observed and the expression of caspase-3 was detected by Western blot.ResultsCompared with IR group,the levels of caspase-3,AI and myocardial injury in M,B and D groups were down-regulated(P<0.05).Compared with D group,the levels of caspase-3,AI and myocardial injury were increased in M and B group the differences were statistical significant(P<0.05).Conclusion The relationship between GSK-3β and Drp-1 of the myocardium protection in rats is not a single dependency.
[Key words]Myocardium;Myocardial ischemia-reperfusion;GSK-3β
随着心胸外科技术发展,冠脉旁路移植术(CABG)等多种治疗手段得以广泛应用,梗死冠状动脉得以再通,但由此引发的心肌缺血再灌注损伤(MRIR)发生率却不断上升。研究证实,激活磷脂酰肌醇-3激酶/蛋白质丝氨酸苏氨酸激酶(PI3K/Akt),蛋白激酶C(PKC),蛋白激酶 A(PKA)和细胞外调节蛋白激酶(ERK)等激酶[1-2],均可引起下游底物糖原合成激酶 3β(GSK-3β)抑制性磷酸化,阻止 caspase-3激活及线粒体介导的内源性凋亡启动,起到保护心肌的作用[3-5]。研究显示,GSK-3β可抑制性磷酸化动力相关蛋白-1(Drp-1)[6],而 Drp-1 作为线粒体分裂调控关键蛋白,在急性缺血损伤中地位重要,其过度表达可促进线粒体分裂[7],促进细胞凋亡,两者之间存在上下游调控关系。然而,Drp-1是否单纯依赖GSK-3β调节有待探讨。
1 对象与方法
1.1 实验动物
清洁健康雄性SD大鼠60只,山西医科大学动物实验中心提供(2016.10)。体重250~300 g。
1.2 仪器/试剂
Drp-1 抑制剂 Mdivi-1(Medchem Express公司,美国),GSK-3β 抑制剂 SB216763(Medchem Express公司,美国),内参GAPDH抗体(abcam公司,英国),免抗鼠caspase-3单抗(abcam公司,英国),羊抗免Ⅱ抗(abcam公司,英国),生物机能实验系统(泰盟公司,四川成都),动物呼吸机(泰盟公司,四川成都),全自动酶标仪(Thermo公司,美国),小型垂直蛋白电泳槽(Bio-rad公司,美国),蛋白转印仪(Bio-rad公司,美国)。
1.3 分组/处理
参照文献[8]方法,大鼠适应性喂养1周。随机分为4组(n=15):缺血再灌注组(IR组)、缺血再灌注+Mivi-1组(M 组)、缺血再灌注+SB216763组(B 组)、缺血再灌注+Mivi-1+SB216763组(D组)。
参照文献[9]制备大鼠MRIR模型,禁食不禁饮8 h后,腹腔注射20%乌拉坦4 ml/kg麻醉,仰卧位恒温试验台固定,针状电极监测标准肢体导联心电图。颈正中气管切开气管插管接动物呼吸机,调节潮气量为2.5 ml/100 g,通气频率 60 次/min,吸呼比 1∶2。于胸骨左缘3、4肋间开胸入胸腔,挤压胸廓暴露心脏,剥离心包,用6-0丝线于左心耳根部2 mm穿过LAD,丝线两端穿过一硅胶套管,牵拉丝线收紧套管并固定,造成人工心肌缺血。心电图实时表现ST段抬高或降低,T波高尖,扎线远端心肌组织发绀,表明出现心肌缺血。30 min后松开丝线进行再灌注,心电图表现ST段下降>1/2,发绀心肌逐步变红,表明心肌再灌注成功。再灌注120 min,大鼠MRIR模型制备成功。
M组再灌注前1 min尾静脉注射Drp-1抑制剂Mivi-1(1.2 mg/kg);B 组再灌注前尾静脉注射SB216763(0.2 mg/kg);D 组再灌注前尾静脉注射 Mivi-1(1.2 mg/kg)及 SB216763(0.2 mg/kg)。再灌注 120 min 时,腹正中切开暴露腹主动脉并取血2 ml。
1.4 指标/方法
1.4.1 血清肌钙蛋白(cTnI浓度)血样室温静置2 min后,4℃ 3500转/min离心5 min,离心半径10 cm,取上层血清,-80℃保存,应用全自动生化分析仪检测。
1.4.2 细胞凋亡 处死大鼠,取部分缺血心肌组织,甲醛固定24 h后,石蜡包埋,切片。TUNEL法检测细胞凋亡情况,染色为棕黄色的细胞为TUNEL阳性细胞,即凋亡细胞;阴性细胞染成蓝色,即正常心肌细胞。随机选取10个400倍视野,计数每100个细胞中凋亡细胞数,计算AI=凋亡细胞数/总细胞数×100%。
1.4.3 病理损伤 取缺血区心肌组织,部分进行HE染色观察心肌病理学结果。将心肌组织经4%多聚甲醛固定72 h,石蜡包埋后切片机切取2~3 μm厚度切片,贴附于载玻片上,烘干。二甲苯中浸泡8 min×3次,直至切片呈透明状,后取出切片并甩掉表面附着二甲苯,置于酒精溶液洗去二甲苯。脱蜡后蒸馏水浸泡5 min,再置于苏木素溶液中浸染5 min,生理盐水冲洗干净后于75%酒精中分化30 s,再用氨水蓝染数秒,后用生理盐水冲洗并用伊红染液染色1 min,酒精脱水。脱水完成后切片浸泡于二甲苯5 min,滴中性树胶完成封片。光学显微镜下观察心肌细胞的病理损伤情况。
1.4.4 caspase水平 取剩余心肌组织,采用Western blot法检测心肌细胞caspase-3的表达。生理盐水灌洗心脏后,取心肌组织加入细胞裂解液,蛋白酶抑制剂,低温下匀浆。4℃下12000×g离心15 min,取上清,采用BCA蛋白定量试剂盒测定蛋白浓度。根据目的蛋白分子量配制分离胶与浓缩胶进行电泳,120 V电泳2 h,后将蛋白转移至PVDF膜。封闭液封闭2 h,加兔抗鼠caspase-3抗体,4℃孵育过夜。TBST液漂洗5 min×3次,加入辣根过氧化物酶标记的山羊抗兔二抗,室温孵育2 h后TBST漂洗5 min×3次,加ECL化学发光液,凝胶成像系统采集图像,Image J软件分析。以caspase-3与GAPDH条带灰度值比值反映其表达水平。
1.5 统计学方法
采用SPSS 21.0统计学软件进行分析,计数资料以率表示,采用χ2检验,以P<0.05为差异有统计学意义。
2 结果
2.1 四组大鼠 caspase-3、AI、cTn I水平的比较
与IR 组比较,M、B、D 组 caspase-3 浓度、AI、cTnI浓度下调(P<0.05);与M、B组分别比较,D组caspase-3浓度、AI、cTnI浓度下调,差异均有统计学意义(P<0.05)(表1、图 1)。
表1 四组大鼠 caspase-3、AI、cTn I水平的比较(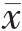 ±s)
±s)
.jpg)
与 I/R 组比较,aP<0.05;与 D 组比较,bP<0.05
.jpg)
图1 四组western blot法测得活化型caspase-3表达量的比较
2.2 四组大鼠光镜下细胞形态的比较
光镜下观察,IR组细胞形态不规则,心肌纤维排列紊乱,胞浆不同程度肿胀甚至破裂,胞核排列不齐,且出现碎裂和溶解,与前者相比,M、B、D组胞浆肿胀程度和细胞核的破坏程度均较轻。
3 讨论
健康雄性SD大鼠,采用阻断LAD血流30 min,再灌注120 min的方法制备大鼠IR模型[9]。结果显示,再灌注120 min后大鼠心肌梗死面积增大,心肌产生病理损伤,血清cTnI含量升高,提示大鼠IR模型制备成功。
Caspase家族蛋白酶是存在于细胞质溶胶中的天门冬氨酸特异性的半胱氨酸蛋白酶,caspase-3参与细胞凋亡的最终执行,反映了细胞的凋亡状况[3]。cTnI是一种心肌特异抗原,平时不能透过细胞膜,心肌应激状态时于血清内短时间激增,对反映心肌损伤具有高度特异性。
本研究结果显示,与IR比较,M、B组caspase-3表达水平下降,心肌损伤程度减轻,提示两者可一定程度起到对心肌的保护作用,并且通过预实验,将两者能产生的心肌保护作用控制到无统计差异的范围内以排除可能通路的干扰。与 M、B组比较,D组caspase-3表达水平,cTnI浓度,AI指数下降,心肌损伤程度减轻,提示GSK-3β与Drp-1之间并非单纯依赖关系,两者之间可能存在其他作用途径。
GSK-3β是PI3K/AKT信号传导通路上重要信号蛋白[1,10],多种心肌保护措施发挥作用须经过其在Ser 9位点发生磷酸化[11],进而抑制线粒体通透转化孔(mPTP)开放[12],最终部分抑制凋亡[13]。 而 Drp-1 的作用是调控线粒体形态,主导其分裂。Clayton等[14]研究发现,GSK-3β可以磷酸化抑制Dynaminl,进而调控神经元突触部位活性囊泡的内吞。这提示Drp-1作为dynmin家族一员的能否被GSK-3β磷酸化并参与到线粒体动态化平衡中。研究显示GSK-3β参与了线粒体介导的细胞凋亡[15-16]。在对神经元细胞的研究中发现[6],用小干扰RNA抑制Drp-1表达之后,GSK-3β无法诱导线粒体的分裂,提示神经元中GSK-3β调控线粒体分裂是依赖于Drp-1的。
有文献显示[17],使用抑制剂Mdivi-1抑制Drp-1也能阻止依赖于Bax/Bak的Cyt C从线粒体释放,说明Drp-1的促凋亡作用可能与线粒体并无关联,提示以上通路可能存在其他影响途径。本实验参照文献[18]选择GSK-3β抑制剂SB216763的剂量,SB216763使GSK-3β磷酸化而活性受抑,恢复PI3K/AKT信号传导通路的保护作用,释放出腺苷等自身保护物质[13],最终减少了mPTP的开放,产生心肌保护效应[19]。采用特异性抑制剂Mdivi-1抑制Drp-1活性[20],抑制线粒体的分裂,进而发挥对受损心肌的保护效应。本实验通过两者同时施加,对比心肌保护效果与单独施加是否有变化进而证明其两者之间是否为单纯依赖关系。
综上所述,GSK-3β与Drp-1在大鼠心肌保护作用中并非单纯依赖的关系。本实验仅通过抑制GSK-3β的表达与Drp-1的线粒体膜移动,单方面讨论了抑制条件下两者之间可能存在的依赖关系,并未通过激活表达的方向进行验证,需进一步研究完善。
[参考文献]
[1]Zhang J,Wang C,Yu S,et al.Sevoflurane postconditioning protects rat hearts against ischemia-reperfusion injury via the activation of PI3K/AKT/mTOR signaling[J].Sci Rep,2014,4:7317.
[2]刘琨,许鹏程.七氟醚预处理对大鼠离体心脏缺血再灌注损伤时自噬的影响及PI3K/Akt信号通路在其中的作用[J].中华麻醉学杂志,2014,34(4): 492-496.
[3]Reubold TF,Eschenburg S.A molecular view on signal transduction by the apoptosome[J].Cell Signal,2012,24(7):1420-1425.
[4]Vancsik T,Kovago C,Kiss E,et al.Modulated electro-hyperthermia induced loco-regional and systemic tumor destruction in colorectal cancer allografts[J].J Cancer,2018,9(1):41-53.
[5]Geetha R,Sathiya PC,Anuradha CV.Troxerutin abrogates mitochondrial oxidative stress and myocardial apoptosis in mice fed calorie-rich diet[J].Chem Biol Interact,2017,278:74-83.
[6]闫靖.GSK3β对Drp1磷酸化调节的机制及其功能的研究[D].济南:山东大学,2013.
[7]Archer SL.Mitochondrial dynamics-mitochondrial fission and fusion in human diseases[J].N Engl J Med,2013,369(23):2236-2251.
[8]王祥,王晓鹏,韩冲芳,等.链脲佐菌素诱导大鼠糖尿病合并心肌缺血再灌注损伤模型的建立与评价[J].中西医结合心脑血管病杂志,2016,14(17):1996-1998.
[9]王强,李瑞萍,薛富善,等.PI3K/Akt和JAK/STAT信号转导通路在三种后处理减轻大鼠缺血再灌注损伤中的作用[J].中华麻醉学杂志,2013,33(8):997-1002.
[10]Smillie KJ,Cousin MA.Akt/PKB controls the activity-dependent bulk endocytosis of synaptic vesicles[J].Traffic,2012,13(7):1004-1011.
[11]王英,谢平,张琳,等.PI3K/Akt/GSK-3β信号通路在二氮嗪后处理减轻大鼠心肌缺血再灌注损伤中的作用:离体实验[J].中华麻醉学杂志,2014,34(10):1237-1240.
[12]Zhang Y,Babcock SA,Hu N,et al.Mitochondrial aldehyde dehydrogenase(ALDH2)protects against streptozotocin-induced diabetic cardiomyopathy:role of GSK3beta and mitochondrial function[J].BMC Med,2012,10:40.
[13]Brooks MM,Neelam S,Fudala R,et al.Lenticular mitoprotection.Part A:monitoring mitochondrial depolarization with JC-1 and artifactual fluorescence by the glycogen synthase kinase-3beta inhibitor,SB216763[J].Mol Vis,2013,19:1406-1412.
[14]Clayton EL,Sue N,Smillie KJ,et al.Dynamin I phosphorylation by GSK3 controls activity-dependent bulk endocytosis of synaptic vesicles[J].Nat Neurosci,2010,13(7):845-851.
[15]Liu H,Peng H,Chen S,et al.S1PR2 antagonist protects endothelial cells against high glucose-induced mitochondrial apoptosis through the Akt/GSK-3beta signaling pathway[J].Biochem Biophys Res Commun,2017,490(3):1119-1124.
[16]Lumetti S,Calciolari E,Parisi L,et al.Study of GSK3b inhibitors SB415286 and SB216763 to improve osteoblastic differentiation on microstructured titanium[J].J Biol Regul Homeost Agents,2017,31(3):579-587.
[17]张琳,叶英,许铁,等.糖原合成激酶3β在二氮嗪后处理糖尿病大鼠心肌缺血/再灌注损伤中的作用[J].国际麻醉学与复苏杂志,2015,36(2):122-126.
[18]D'Urzo A,De Simone A,Fiori J,et al.D IRect determination of GSK-3beta activity and inhibition by UHPLC-UV-vis diode arrays detector(DAD)[J].J Pharm Biomed Anal,2016,124:104-111.
[19]Hibbert B,Lavoie JR,Ma X,et al.Glycogen synthase kinase-3beta inhibition augments diabetic endothelial progenitor cell abundance and functionality via cathepsin B:a novel therapeutic opportunity for arterial repa IR[J].Diabetes,2014,63(4):1410-1421.
[20]Gao D,Yang J,Wu Y,et al.Targeting dynamin 2 as a novel pathway to inhibit cardiomyocyte apoptosis following oxidative stress[J].Cell Physiol Biochem,2016,39(6):2121-2134.
(收稿日期:2017-11-06
本文编辑:崔建中)