雷公藤甲素对人肾癌A498细胞增殖、迁移及侵袭的影响
曹 波1 付 刚2 王晓敏3 柴春香1 张兆光4 陈学勋5▲
1.潍坊医学院附属医院急诊科,山东潍坊 261041;2.山东省潍坊市益都中心医院泌尿外科,山东青州 262500;3.山东省潍坊市益都中心医院病理科,山东青州 262500;4.潍坊医学院附属医院超声科,山东潍坊 261041;5.潍坊医学院附属医院肾内科,山东潍坊 261041
[摘要]目的 探讨雷公藤甲素对人肾癌A498细胞增殖、迁移及侵袭的影响。方法 取不同浓度雷公藤甲素作用于肾癌A498细胞,浓度分别为0、200、400 nmol/L,定义为对照组、低剂量组、高剂量组。采用蛋白质印迹法(Western Blot)检测肾癌A498细胞中AKT、p-AKT、MTOR、p-MTOR的表达,并评估肾癌A498细胞的增殖、迁移及侵袭情况。结果 高剂量组、低剂量组的p-AKT、p-MTOR表达均低于对照组,高剂量组的p-AKT、p-MTOR表达低于低剂量组,差异有统计学意义(P<0.05)。高剂量组、低剂量组的细胞增殖、迁移、侵袭能力均低于对照组,高剂量组的细胞增殖、迁移、侵袭能力低于低剂量组,差异有统计学意义(P<0.05)。结论 雷公藤甲素可通过阻断PI3K/AKT/MTOR信号通路抑制肾癌A498细胞的增殖、迁移和侵袭。
[关键词]雷公藤甲素;肾癌;A498细胞;PI3K/AKT/MTOR信号通路;增殖;迁移;侵袭
肾细胞癌(RCC)是成年人肾脏恶性肿瘤的最常见类型,起源于近曲小管,所占比例约90%[1-2]。手术治疗是首选治疗方法,RCC的5年存活率可达到65%~90%[1]。当癌细胞转移,或者因其他疾病失去手术机会时,存活率大大降低,因此积极探索晚期RCC 有效治疗药物成为研究热点。PI3K/AKT/MTOR信号通路的激活在肾癌细胞的增殖、迁移、侵袭中起到重要的作用[3-8]。雷公藤甲素是雷公藤植物的有效成分提取物,可通过诱导肿瘤细胞的凋亡、干扰肿瘤细胞周期、抑制肿瘤血管生成,从而达到抗肿瘤的效果[9-10]。近几年研究发现,雷公藤甲素可通过PI3K/AKT/MTOR信号通路抑制卵巢癌细胞和胃癌细胞的增殖及侵袭[11-13],而在肾细胞癌中的作用鲜有报道。本研究探讨雷公藤甲素通过PI3K/AKT/MTOR信号通路对肾癌A498细胞增殖、迁移和侵袭的影响,旨在为进一步研究提供依据。
1 材料与方法
1.1 材料
肾癌A498细胞(ATCC 细胞库);雷公藤甲素(美国sigma 公司);β-actin、AKT、p-AKT、MTOR、p-MTOR单克隆抗体(福州迈新生物技术公司);MTT 试剂盒(北京普洛麦格生物技术公司);蛋白提取试剂盒、BCA蛋白浓度检测试剂盒、5×SDS 蛋白上样缓冲液、二甲基亚砜及牛血清白蛋白(广州碧云天生物技术研究所);ECL 试剂盒(北京普利莱基因技术有限公司);Transwell 小室(美国Corning 公司)。
1.2 方法
1.2.1 细胞系和培养环境 A498细胞在含10%FBS的RPMI-1640 培养基中培养,在37℃、5%CO2的细胞培养箱中培养。雷公藤甲素配置:将1 mg 雷公藤甲素加入3.47 mL的二甲基亚砜中溶解,再加入0.9%的无菌生理盐水稀释成相应终浓度的雷公藤甲素,过滤膜过滤后再分装至EP 管,放在-20℃冰箱中备用。
1.2.2 实验分组 经雷公藤甲素浓度(0、0.1、0.5、1、5、10、50 μmol/L)筛选实验后,确定IC50,根据IC50 确定雷公藤甲素相对最佳剂量,共分为3组:对照组为雷公藤甲素0 nmol/L、低剂量组为雷公藤甲素200 nmol/L、高剂量组为雷公藤甲素400 nmol/L。
1.2.3 Western Blot 细胞在RIPA 裂解液中4℃下裂解20 min,之后细胞裂解液10 000 g 下离心10 min清除杂物,蛋白浓度通过BCA 进行测定。装载样品并在10%SDS-PAGE 凝胶进行电泳分离,之后蛋白转移至PVDF 膜,膜在5%牛血清白蛋白(BSA)室温下封闭1 h,与原抗体分别在4℃过夜。TBS-tween 三次洗涤后,进一步在室温下与羊抗兔或羊抗小鼠辣根过氧化物酶标记的二抗反应1 h。蛋白检测采用电化学发光(ECL)试剂盒,条带密度通过Quantity One 软件进行测定。
1.2.4 细胞侵袭实验 24 孔细胞培养板与多孔聚乙烯对苯二甲酸酯膜(8 μm 孔径)分别用于检测细胞侵袭能力。上层培养板为覆膜胶,然后接种5×105 活细胞在DMEM 培养基。下层培养基中添加20%FBS 作为趋化因子。37℃下培养16 h后,细胞侵袭至膜的下面,用PBS 冲洗,甲醇固定和水晶蓝染色。在7个随机域的光镜下计数细胞数。
1.2.5 细胞迁移实验 通过24 孔板细胞培养对细胞的迁移能力进行分析。上室接种5×105 活细胞,下室充满了含20%胎牛血清的DMEM 培养基中作为趋化因子。37℃下培养16 h后,穿过膜的细胞用PBS 冲洗,甲醇固定和水晶蓝染色。在7个随机域的光镜下计数细胞数。
1.2.6 细胞增殖实验 细胞接种于96 孔培养板,密度为0.3×103个/孔。细胞培养8 h后,每24小时加入不同浓度的雷公藤甲素。在48 h 加入MTT。细胞在37℃下培养4 h后完全去除培养基。然后每孔加入150 μL二甲基亚砜(DMSO)溶液。在黑暗下摇晃15 min,然后用酶标仪测定在490 nm 处细胞的光密度(optical density,OD)值。
1.3 统计学方法
采用SPSS 26.0 统计学软件进行数据分析,计量资料用均数±标准差(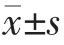 )表示,多组间比较采用单因素方差分析,两组间比较采用q 检验,以P<0.05为差异有统计学意义。
)表示,多组间比较采用单因素方差分析,两组间比较采用q 检验,以P<0.05为差异有统计学意义。
2 结果
2.1 三组AKT、p-AKT、MTOR 和p-MTOR蛋白表达情况的比较
高剂量组、低剂量组的p-AKT、p-MTOR表达均低于对照组,高剂量组的p-AKT、p-MTOR表达低于低剂量组,差异有统计学意义(P<0.05)。三组的AKT和MTOR蛋白比较,差异无统计学意义(P>0.05)(图1、表1)。

图1 三组AKT、p-AKT、MTOR 和p-MTOR蛋白的表达情况
表1 三组AKT、p-AKT、MTOR 和p-MTOR蛋白表达情况的比较(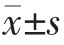 )
)
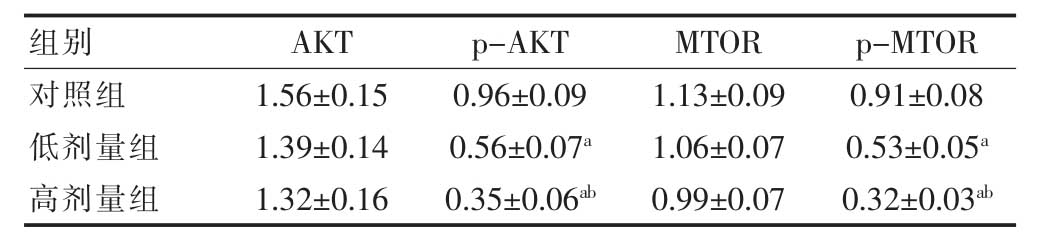
与对照组比较,aP<0.05;与低剂量组比较,bP<0.05
2.2 三组不同时间点OD值的比较
高剂量组、低剂量组24、48、72 h的OD值低于对照组,高剂量组24、48、72 h的OD值低于低剂量组,差异有统计学意义(P<0.05);对照组、低剂量组、高剂量组48、72 h的OD值均高于24 h,差异有统计学意义(P<0.05)(表2)。
表2 三组不同时间点OD值的比较(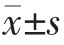 )
)
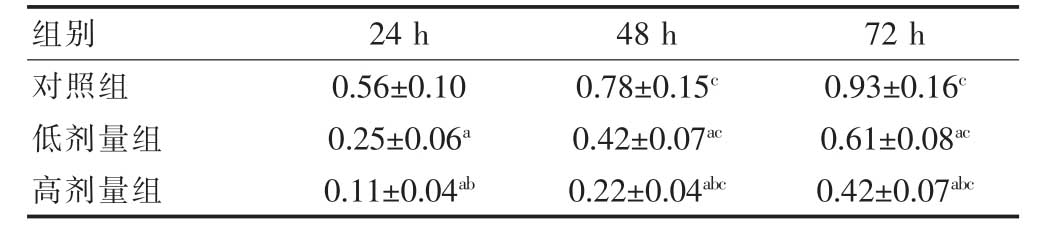
与对照组同期比较,aP<0.05;与低剂量组同期比较,bP<0.05;与本组24 h 比较,cP<0.05
2.3 三组细胞迁移、侵袭能力的比较
高剂量组、低剂量组的细胞迁移、侵袭能力均低于对照组,高剂量组的细胞迁移、侵袭能力低于低剂量组,差异有统计学意义(P<0.05)(表3)。
表3 三组细胞迁移、侵袭能力的比较(个/视野, )
)

与对照组比较,aP<0.05;与低剂量组比较,bP<0.05
3 讨论
RCC是最常见的泌尿系统恶性肿瘤,发病较隐匿,且侵袭性较强,多数发展到晚期才被发现[1-2]。因对放疗和化疗等保守性治疗不敏感,外科手术仍是最佳的治疗方法,虽然联合新辅助性化疗方案取得较好的疗效,但是患者术后复发和转移率仍较高[1-2,14]。近期研究发现,靶向药物具有精准治疗及全身副作用少的优势,成为晚期肾细胞癌的主要治疗手段之一,为晚期患者提供更有效的治方案,从而提高患者的生存期和生存质量[3,15-16]。
PI3K/AKT/MTOR信号通路在细胞中广泛存在,并参与细胞的增殖、凋亡及血管生成等[3]。近年来研究发现,PI3K/AKT/MTOR信号通路的激活与多种肿瘤的发生有关,针对此信号通路的分子靶向治疗成为目前研究的热点[15-18],通过抑制PI3K/AKT/MTOR信号通路的激活,可以降低肝癌、胃癌、肺癌和乳腺癌等多种癌细胞的生长、迁移和侵袭能力[19-24]。有研究运用PI3K/MTOR 双重阻断剂NVP-BEZ235 体外处理肾癌A498细胞系,明显抑制肾癌A498细胞系中磷酸化蛋白p-AKT 和p-MTOR的表达,从而抑制肾癌细胞的增殖、迁移和侵袭[4]。前期研究表明,激活PI3K/AKT/MTOR信号通路,可促进肾癌细胞的迁移和侵袭。以上研究充分说明PI3K/AKT/MTOR信号通路在肾癌细胞的增殖、迁移和侵袭中起到重要的作用[8]。
雷公藤甲素是传统中药雷公藤的提取物,自发现雷公藤甲素有抗肿瘤作用后,诸多研究通过多途径多通路诱导肿瘤细胞的凋亡、干扰肿瘤细胞周期、抑制肿瘤血管生成,从而达到抗肿瘤的效果[9]。阎玮兰[11]研究发现雷公藤甲素通过抑制MV411 细胞PI3KAKT-mTOR 通路蛋白的表达,从而抑制MV411 细胞的增殖。王昊等[12]同样发现雷公藤甲素对TM4 细胞氧化应激及PI3K/AKT 通路有明显抑制作用。白俊等[13]发现雷公藤甲素通过PI3K/AKT/mTOR 通路诱导卵巢颗粒细胞自噬。以上研究均评价了雷公藤甲素通过影响PI3K/AKT/MTOR信号通路对肿瘤细胞起到抑制作用,而在肾细胞癌中报道少见[11-13]。本研究通过检测AKT、p-AKT、MTOR、p-MTOR表达情况来评价雷公藤甲素对其影响,从而明确雷公藤甲素是否通过该通路起到抗肿瘤的作用,结果显示,高剂量组、低剂量组的p-AKT、p-MTOR表达均低于对照组,高剂量组的p-AKT、p-MTOR表达低于低剂量组,差异有统计学意义(P<0.05),提示雷公藤甲素可以抑制肾癌A498细胞系中PI3K/AKT/MTOR信号通路的激活。细胞增殖、迁移和侵袭是肾癌发生、发展的重要生物学特性[1-3,8],也是肿瘤治疗的难点。本研究结果显示,高剂量组、低剂量组24、48、72 h的OD值低于对照组,高剂量组24、48、72 h的OD值低于低剂量组,差异有统计学意义(P<0.05)。肿瘤细胞的侵袭、转移与预后关系密切,是影响抗肿瘤治疗效果的关键因素之一[1-2,8]。通过对细胞迁移、侵袭的实验室评价,结果显示高剂量组、低剂量组的细胞迁移、侵袭能力均低于对照组,高剂量组的细胞迁移、侵袭能力低于低剂量组,差异有统计学意义(P<0.05)。提示雷公藤甲素通过抑制PI3K/AKT/MTOR信号通路的激活,从而抑制肾癌A498细胞的增殖、迁移和侵袭能力,与以往报道一致[10-13]。
综上所述,雷公藤甲素可通过抑制PI3K/AKT/MTOR信号通路,从而抑制肾癌A498细胞的增殖、迁移和侵袭,为今后肾癌细胞药物治疗及具体机制研究提供理论思路。
[参考文献]
[1]Soleimani A,Rahmani F,Ferns GA,et al.Role of regulatory oncogenic or tumor suppressor miRNAs of PI3K/AKT signaling axis in the pathogenesis of colorectal cancer[J].Curr Pharm Des,2018,24(39):4605-4610.
[2]Errarte P,Larrinaga G.The role of cancer-associated fibroblasts in renal cell carcinoma an example of tumor modulation through tumor/non-tumor cell interactions[J].J Adv Res,2020,21(9):103-108.
[3]Kumar A,Kumari N,Gupta V.Renal cell carcinoma:molecular aspects[J].Indian J Clin Biochem,2018,33(3):246-254.
[4]郭双双,张治业,王颖.PI3K/AKT/MTOR信号通路对肾癌A498细胞增殖、迁移及侵袭的影响研究[J].癌症进展,2017,15(12):1412-1416.
[5]潘理会,张平,李春辉.PI3K/AKT/mTOR信号传导通路在胃癌中的研究进展[J].承德医学院学报,2016,33(4):324-327.
[6]卢训西,国琳玮,李小光.P13K/AKT/mTOR 通路及其抑制剂在乳腺癌中的应用现状[J].中国癌症杂志,2020,30(2):154-160.
[7]Ediriweera MK,Tennekoon KH.Role of the PI3K/AKT/mTOR signaling pathway in ovarian cancer:Biological and therapeutic significance[J].Semin Cancer Biol,2019,59(11):146-160.
[8]Sun Z,Cao B.Protease-activated receptor 2 enhances renal cell carcinoma cell invasion and migration via PI3K/AKT signaling pathway[J].Exp Mol Pathol,2015,98(3):382-389.
[9]黄宇,马全鑫,凌云.雷公藤甲素抗肿瘤药理作用的研究进展[J].药物评价研究,2018,41(2):328-333.
[10]石金凤,罗尧尧,李佳鑫.雷公藤甲素单用及联合用药抗肿瘤的作用及机制研究进展[J].中国中药杂志,2019,44(16):3391-3398.
[11]阎玮兰.雷公藤甲素对MV411 细胞增殖抑制及在PI3KAKT-mTOR 通路机制研究[D].太原:山西医科大学,2017.
[12]王昊,陈亮,叶小云.雷公藤甲素对TM4 细胞氧化应激及PI3K/AKT 通路的影响[J].北京大学学报(医学版),2018,50(4):607-612.
[13]白俊,吴也可,吴克明.雷公藤甲素通过PI3K/AKT/mTOR通路诱导卵巢颗粒细胞自噬的实验研究[J].中国中药杂志,2019,44(16):3429-3434.
[14]Bergerot P,Lamb P,Wang E.Cabozantinib in combination with immunotherapy for advanced renal cell carcinoma and urothelial carcinoma:rationale and clinical evidence[J].Mol Cancer Ther,2019,18(12):2185-2193.
[15]Damayanti NP,Budka JA,Khella HWZ,et al.Therapeutic targeting of TFE3/IRS-1/PI3K/mTOR axis in translocation renal cell carcinoma[J].Clin Cancer Res,2018,24(23):5977-5989.
[16]Bodnar L,Stec R,Cierniak S,et al.Clinical usefulness of PI3K/Akt/mTOR genotyping in companion with other clinical variables in metastatic renal cell carcinoma patients treated with everolimus in the second and subsequent lines[J].Ann Oncol,2015,26(7):1385-1389.
[17]Ribback S,Cigliano A,Kroeger N,et al.PI3K/AKT/mTOR pathway plays a major pathogenetic role in glycogen accumulation and tumor development in renal distal tubules of rats and men[J].Oncotarget,2015,6(15):13 036-13 048.
[18]Vlachostergios PJ.PI3K/AKT inhibitors in patients with refractory renal cell carcinoma:what have we learnt so far?[J].Ann Oncol,2017,28(5):914-916.
[19]Corti F,Nichetti F,Raimondi A,et al.Targeting the PI3K/AKT/mTOR pathway in biliary tract cancers:A review of current evidences and future perspectives[J].Cancer Treat Rev,2019,72(7):45-55.
[20]Barra F,Evangelisti G,Ferro Desideri L,et al.Investigational PI3K/AKT/mTOR inhibitors in development for endometrial cancer[J].Expert Opin Investig Drugs,2019,28(2):131-142.
[21]Soleimani A,Rahmani F,Ferns GA,et al.Role of Regulatory Oncogenic or Tumor Suppressor miRNAs of PI3K/AKT Signaling Axis in the Pathogenesis of Colorectal Cancer[J].Curr Pharm Des,2018,24(39):4605-4610.
[22]Corti F,Nichetti F,Raimondi A,et al.Targeting the PI3K/AKT/mTOR pathway in biliary tract cancers:A review of current evidences and future perspectives[J].Cancer Treat Rev,2019,72(7):45-55.
[23]Khan MA,Jain VK,Rizwanullah M,et al.PI3K/AKT/mTOR pathway inhibitors in triple-negative breast cancer:a review on drug discovery and future challenges[J].Drug Discov Today,2019,24(11):2181-2191.
[24]胡志英,朱新江,陈舒晨,等.非小细胞肺癌PI3K/AKT/MTOR信号通路的研究现状与进展[J].癌症进展,2018,16(6):671-674.
Effect of triptolide on human renal carcinoma A498 cells proliferation,migration and invasion
CAO Bo1 FU Gang2 WANG Xiao-min3 CHAI Chun-xiang1 ZHANG Zhao-guang4 CHEN Xue-xun5▲
1.Department of Emergency, Affiliated Hospital of Weifang Medical College, Shandong Province, Weifang 261041,China;2.Department of Urinary Surgery, Weifang Yidu Central Hospital, Shandong Province, Qingzhou 262500, China;3.Department of Pathology, Weifang Yidu Central Hospital, Shandong Province, Qingzhou 262500, China;4.Department of Ultrasound, Affiliated Hospital of Weifang Medical College, Shandong Province, Weifang 261041, China;5.Department of Nephrology, Affiliated Hospital of Weifang Medical College, Shandong Province, Weifang 261041,China
1.Department of Emergency, Affiliated Hospital of Weifang Medical College, Shandong Province, Weifang 261041,China;2.Department of Urinary Surgery, Weifang Yidu Central Hospital, Shandong Province, Qingzhou 262500, China;3.Department of Pathology, Weifang Yidu Central Hospital, Shandong Province, Qingzhou 262500, China;4.Department of Ultrasound, Affiliated Hospital of Weifang Medical College, Shandong Province, Weifang 261041, China;5.Department of Nephrology, Affiliated Hospital of Weifang Medical College, Shandong Province, Weifang 261041,China
[Abstract]Objective To investigate the effect of triptolide on the proliferation, migration and invasion of human renal carcinoma A498 cells.Methods A498 cells exposed to different concentrations of triptolide.The concentrations of triptolide were 0, 200, and 400 nmol/L, which were defined as control group, low-dose group and high-dose group.Western Blot was used for testing the expressions of AKT, p-AKT, MTOR and p-MTOR in A498 cells, and the proliferation, migration and invasion were evaluated.Results The expressions of p-AKT and p-MTOR in the low-dose group and highdose group were lower than those in the control group, the expressions of p-AKT and p-MTOR in the high-dose group were lower than those in the low-dose group, and the differences were statistically significant (P<0.05).The proliferation,migration and invasion ability of A498 cells in the low-dose group and high-dose group were lower than those of the control group, the proliferation, migration and invasion ability of A498 cells in the high-dose group were lower than those of the low-dose group, and the differences were statistically significant (P<0.05).Conclusion Triptolide can inhibit the proliferation, migration and invasion of A498 cells by blocking the PI3K/AKT/mTOR signal pathway.
[Key words]Triptolide;Ranal carcinoma;A498 cell;PI3K/AKT/mTOR signaling pathway;Proliferation;Migration;Invasion
[中图分类号]R737.11
[文献标识码]A
[文章编号]1674-4721(2021)3(b)-0009-04
[基金项目]山东省中医药科技发展计划项目(2019-0422);山东省医药卫生科技发展计划项目(2017WS172)
[作者简介]曹波(1976-),男,山东潍坊人,本科,副主任医师,研究方向:肾脏肿瘤
▲通讯作者:陈学勋(1981-),男,山东潍坊人,硕士,研究方向:肾脏病学
(收稿日期:2020-10-16)