奥氮平在预防晚期非小细胞肺癌患者化疗所致恶心、呕吐中的临床应用
王 雷 王明吉
大连市友谊医院肿瘤内科,辽宁大连 116001
[摘要]目的 探讨奥氮平预防晚期非小细胞肺癌患者化疗所致恶心、呕吐的临床效果及安全性。方法 选取2016年11月~2019年11月就诊于大连市友谊医院的50例晚期非小细胞肺癌化疗所致恶心、呕吐患者,按照随机数字表法将其分为观察组(n=25)及对照组(n=25)。两组均给予顺铂联合紫杉醇/多西他赛化疗。对照组患者预防性应用盐酸昂丹司琼注射液,观察组患者预防性应用奥氮平联合盐酸昂丹司琼注射液止吐。记录两组患者化疗后恶心、呕吐症状完全缓解率,比较两组的生活质量及不良反应发生情况。结果 两组患者的急性恶心、急性呕吐完全缓解率比较,差异无统计学意义(P>0.05)。观察组患者的延迟性恶心、延迟性呕吐完全缓解率均高于对照组,差异有统计学意义(P<0.05)。观察组患者生活质量量表的情绪功能评分高于对照组,差异有统计学意义(P<0.05);观察组患者生活质量量表的恶心与呕吐、食欲下降评分低于对照组,差异有统计学意义(P<0.05)。观察组患者的嗜睡和头晕发生率高于对照组,差异有统计学意义(P<0.05)。结论 奥氮平在预防晚期非小细胞肺癌患者化疗所致的延迟性恶心、呕吐中有较好的疗效,且可提高患者的生活质量。
[关键词]奥氮平;恶心;呕吐;生活质量
肺癌是目前发病率和死亡率最高的恶性肿瘤[1],随着现代分子生物学及免疫学的飞速发展,肺癌的治疗已由传统化疗发展成分子靶向治疗及免疫治疗的时代,但化疗的地位仍不容忽视。非小细胞肺癌的化疗以铂类联合第三代新药为主,其中顺铂联合多西他赛/紫杉醇是非小细胞肺癌化疗的标准方案之一[2]。然而在化疗的同时,会产生一些毒副作用,包括恶心、呕吐等胃肠道反应,降低了患者的治疗依从性和生活质量,可导致脱水、电解质紊乱、营养缺乏、焦虑、体力状况评分降低、治疗依从性降低、免疫力下降等严重后果[3]。目前化疗相关恶心、呕吐以5-羟色胺(5-hydroxytryptamine,5-HT)3 受体拮抗剂联合地塞米松的治疗为主,还包括中枢神经系统中激活神经激肽-1(neurokinin-1,NK-1)受体拮抗剂、类固醇类等药物,其中仍有30%的恶心、呕吐未获得完全的控制,恶心、呕吐依然是造成患者生活质量降低的重要因素[4]。奥氮平属于非典型抗精神病药物,是一种5-HT2A/多巴胺D2 拮抗剂[5]。本研究旨在探讨奥氮平用于预防非小细胞肺癌化疗中所致恶心、呕吐的临床效果和安全性,现报道如下。
1 资料与方法
1.1 一般资料
选取2016年11月~2019年11月就诊于大连市友谊医院的50例晚期非小细胞肺癌化疗所致恶心、呕吐患者。纳入标准:①所有患者均通过组织学及细胞学诊断为ⅢB/Ⅳ期非小细胞肺癌[6];②年龄≥18岁;③美国东部肿瘤协作组(Eastern Cooperative Oncology Group,ECOG)评分≤2分;④足够的骨髓功能储备(中性粒细胞≥1.5×109/L;血小板≥100×109/L;血红蛋白≥90 g/L);⑤足够的肾功能储备(血清肌酐≤1.5 mg/dL);⑥足够的肝功能储备(血清总胆红素≤1.5 mg/dL);⑦心脏功能正常;⑧患者及家属同意,并签署知情同意书。排除标准:①有脑转移癌等中枢神经系统疾病及消化系统可引起恶心、呕吐的疾病;②对奥氮平有过敏史;③不能口服药物者;④有精神疾病史者;⑤化疗24 h 前已出现呕吐者;⑥合并心、肝、肾及造血系统严重疾病者。
按照随机数字表法将其分为观察组及对照组。观察组25例,男10例,女15例;年龄42~79岁,平均(65.32±6.76)岁;鳞癌8例,腺癌17例;吸烟9例,不吸烟16例;ECOG 评分0分2例,1 分20例,2 分3例;一线化疗9例,二线化疗11例,三线及以上化疗5例;ⅢB期4例,Ⅳ期21例。对照组25例,男14例,女11例;年龄45~77岁,平均(62.68±6.12)岁;鳞癌11例,腺癌14例;吸烟10例,不吸烟15例;ECOG 评分0分4例,1 分17例,2 分4例;一线化疗12例,二线化疗10例,三线及以上化疗3例;ⅢB期6例,Ⅳ期19例。两组患者的一般资料比较,差异无统计学意义(P>0.05),具有可比性。本研究已经大连市友谊医院医学伦理委员会审核批准。
1.2 方法
1.2.1 化疗方案 两组患者均给予顺铂(江苏豪森药业股份有限公司,国药准字H20040813)联合紫杉醇(扬子江药业集团有限公司,国药准字H20053001)/多西他赛(齐鲁制药有限公司,国药准字H20031244))化疗。顺铂联合紫杉醇方案:化疗第1天用药,静脉滴注顺铂,剂量25 mg/m2,连续滴注3 d,同时第1天滴注紫杉醇,滴注剂量135 mg/m2,滴注3 h,每21 天为1个周期。顺铂联合多西他赛方案:化疗第1天用药,静脉滴注顺铂,剂量25 mg/m2,连续滴注3 d,同时第1天滴注多西他赛,滴注剂量75 mg/m2,滴注2 h,每21 天为1个周期。
1.2.2 治疗方法 对照组于化疗当天至第3天应用盐酸昂丹司琼注射液(江苏奥赛康药业股份有限公司,国药准字H20060196)8 mg 化疗前30 min 静脉滴注,观察组于化疗前1 d 应用奥氮平(江苏豪森药业股份有限公司,国药准字H200110799)5 mg 每晚1次口服5 d,并于化疗当天至第3天应用盐酸昂丹司琼注射液8 mg 化疗前30 min 静脉滴注。
1.3 观察指标及评价标准
观察两组患者的恶心、呕吐症状完全缓解率、生活质量评分及药物相关不良反应发生情况。
①恶心、呕吐症状的完全缓解率:恶心、呕吐症状的分级参考国立癌症研究所的常规毒性判定标准(NCI CTC version 3.0)版常见不良反应分级标准。急性化疗导致的恶心、呕吐在化疗后数分钟至数小时内发生,常在24 h 内缓解;延迟性化疗导致的恶心、呕吐发生在化疗24 h后。故在化疗后24 h 内及化疗第5 天分别由患者报告,医生参照NCI CTC version 3.0版评价标准0~5级进行分级和记录。使用5 d后以控制呕吐和恶心完全有效为完全缓解,评价疗效。②生活质量评估:采用欧洲癌症研究和治疗组织肿瘤患者生存质量量表(EORTC QLQ-C30 version 3.0)进行问卷调查评估。EORTC QLQ-C30 由30个项目组成,包括5个功能量表(躯体、角色、认知、情绪和社会功能)、3个症状量表(疲劳、疼痛、恶心呕吐)、6个单项测量项目(每项作为一个领域)和1个总体健康状况/生命质量领域,由受试者本人完成此表。基于EORTCQLQ-C30评分手册说明,将每个项目的原始数据转换成0~100分。对于EORTCQLQ-C30 问卷调查,整体健康状态评分越高表明生活质量越高;功能性量表评分越高表明生活质量越高;症状量表评分越高表明症状越明显。多项研究显示[7-8],此量表的信度系数(Cronbach′s α)>0.7,可靠性高。患者于治疗第5 天填写EORTC QLQC30 问卷。两组患者EORTC QLQ-C30 问卷回收率为100%。③药物相关不良反应发生情况:记录两组应用相关药物的不良反应发生情况,主要为嗜睡、失眠、便秘、头晕、食欲增加和谷丙转氨酶(alanine aminotransferase,ALT)升高等。
1.4 统计学方法
采用SPSS 22.0 统计学软件进行数据分析,计量资料用均数±标准差(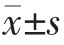 )表示,两组间比较采用t 检验;计数资料采用率表示,组间比较采用χ2 检验,以P<0.05为差异有统计学意义。
)表示,两组间比较采用t 检验;计数资料采用率表示,组间比较采用χ2 检验,以P<0.05为差异有统计学意义。
2 结果
2.1 两组患者恶心、呕吐症状完全缓解率的比较
两组患者的急性恶心、急性呕吐完全缓解率比较,差异无统计学意义(P>0.05);观察组患者的延迟性恶心、延迟性呕吐完全缓解率均高于对照组,差异有统计学意义(P<0.05)(表1)。
表1 两组患者恶心、呕吐症状完全缓解率的比较[n(%)]
.jpg)
2.2 两组患者生活质量评分的比较
观察组患者生活质量量表的情绪功能评分高于对照组,差异有统计学意义(P<0.05);观察组患者生活质量量表的恶心与呕吐、食欲下降评分低于对照组,差异有统计学意义(P<0.05);两组患者的总健康状况、躯体功能、角色功能、认知功能、社会功能、疲倦、疼痛、呼吸困难、失眠、便秘、腹泻及经济困难评分比较,差异无统计学意义(P>0.05)(表2)。
表2 两组患者生活质量评分的比较(分,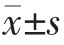 )
)
.jpg)
2.3 两组患者不良反应发生率的比较
观察组患者的嗜睡和头晕发生率高于对照组,差异有统计学意义(P<0.05);两组患者的失眠、便秘、食欲增加、ALT 升高发生率比较,差异无统计学意义(P>0.05)(表3)。
表3 两组患者不良反应发生率的比较[n(%)]
.jpg)
3 讨论
晚期非小细胞肺癌的化疗仍主要以顺铂为基础的两药联合治疗,有效率能达到20%~30%[9]。化疗后的恶心、呕吐成为含顺铂化疗患者难以耐受的最主要的不良反应,频繁的呕吐会导致进食困难,以致营养缺乏,机体免疫力下降,甚至可出现水、电解质紊乱,酸碱失衡等使患者的治疗效果及生活质量降低,严重危及生命[10]。
延脑极后区及肠嗜铬细胞附近的迷走神经末端广泛存在诱导化疗后呕吐的受体。传入神经将呕吐信号传到脑干进行反射处理,后将传出信号传递到不同的器官和组织,引发恶心、呕吐[11]。且化疗药物可引发肠嗜铬细胞释放血清素,活化迷走神经的5-HT3 受体,后将呕吐信号传递到大脑[12-13]。其一般分为外周途径和中枢途径。外周途径多引发急性呕吐(0~24 h)。中枢途径通常表现为药物引发的延迟性呕吐(25~120 h)。目前预防恶心、呕吐的药物主要包括多巴胺受体拮抗剂、5-HT3 受体拮抗剂、NK-1 受体拮抗剂等。盐酸昂丹司琼主要下调中枢神经内5-HT3 受体和外周神经元的兴奋性,并阻止中枢神经系统5-HT3 受体传递的迷走神经传入后区,从而对恶心呕吐起到治疗作用。大多数预防恶心、呕吐药物主要阻断某一类受体,而奥氮平可阻滞恶心、呕吐通路的多个受体[14]。
一项荟萃分析[15]提示奥氮平在预防延迟性恶心、呕吐具有明显优势,5 mg/d 与10 mg/d剂量的效果无明显差异。考虑研究纳入患者年龄及一般状况,本研究给予奥氮平5 mg/d的应用剂量。Sutherland 等[16]在一项奥氮平治疗肿瘤相关恶心、呕吐的研究中,提示奥氮平对于急性呕吐未见明显疗效,在延迟性恶心、呕吐的预防上差异有统计学意义,风险比分别为1.71和1.28。在奥氮平应用剂量上5 mg/d 与10 mg/d 无统计学差异,但低剂量奥氮平其不良反应明显减少。Osman 等[17]在奥氮平联合昂丹司琼、地塞米松对比昂丹司琼、地塞米松的研究中,显示急性恶心组缓解率分别为86.0%和71.6%(P=0.086),延迟性恶心组缓解率分别为72.0%和30.9%(P<0.001);急性呕吐组缓解率分别为86.0%和74.1%(P=0.127),延迟性呕吐组缓解率分别为72.0%和29.6%(P<0.001);联合奥氮平组主要不良反应为1、2级嗜睡及镇静。Shivaprakash 等[18]对于奥氮平对比阿瑞匹坦预防应用阿霉素联合环磷酰胺方案化疗的乳腺癌患者恶心、呕吐的研究显示,奥氮平组和阿瑞匹坦组的急性恶心呕吐缓解率分别为85%和81%(P=0.661),延迟性恶心、呕吐的缓解率分别为85%和74%(P=0.233),差异均无统计学意义。本研究结果显示,两组的急性恶心、急性呕吐完全缓解率比较,差异无统计学意义(P>0.05)。观察组的延迟性恶心、延迟性呕吐完全缓解率均高于对照组,差异有统计学意义(P<0.05)。与上述多项研究基本一致。
Tan 等[19]就奥氮平联合阿扎司琼和地塞米松对比阿扎司琼联合地塞米松预防化疗诱导的恶心、呕吐的研究,对于高致吐性化疗药物所致的延迟性恶心、呕吐的完全缓解率分别为60.64%和30.43%(P<0.05);奥氮平组EORTC QLQ-C30 功能评分在总健康状况、情绪功能、社会功能、疲倦、恶心和呕吐、失眠、食欲下欲有明显优势(P<0.01)。本研究中,观察组生活质量量表的情绪功能评分高于对照组,差异有统计学意义(P<0.05);观察组生活质量量表的恶心与呕吐、食欲下降评分低于对照组,差异有统计学意义(P<0.05)。考虑奥氮平作为抗精神疾病用药,对于情绪功能及食欲方面,可能具有更好的疗效。
在安全性上,多项研究[20-22]显示联用奥氮平组不良反应主要以嗜睡、乏力、头晕、转氨酶升高为主,未见严重不良反应。本研究不良反应方面,观察组患者的嗜睡和头晕发生率较对照组高,差异有统计学意义(P<0.05),其余不良反应发生率比较,差异无统计学意义(P>0.05),与上述研究基本一致。本研究嗜睡及头晕症状发生率较高,但未见严重不良反应,不良反应可耐受,停药1~2周后症状均消失。结合以上研究,奥氮平可作为预防晚期非小细胞肺癌化疗恶心、呕吐的优选药物,但作为止吐药物在临床上的应用仍需密切监测其不良反应。本研究样本量较少,需要更大样本的研究。
综上所述,奥氮平在预防晚期非小细胞患者化疗所致的延迟性恶心、呕吐中效果更佳;其不良反应增加主要有嗜睡、头晕等,不良反应可控,但应用的同时仍需监测其不良反应;在生活质量上对于情绪功能、失眠、食欲方面有明显提高。
[参考文献]
[1]Siegel RL,Miller KD,Jemal A.Cancer statistics,2018[J].CA Cancer J Clin,2018,68(1):7-30.
[2]Lima ABC,Macedo LT,Sasse AD,et al.Addition of bevacizumab to chemotherapy in advanced non-small cell lung cancer:a systematic review and meta-analysis[J].PLoS One,2011,6(8):e22681.
[3]Hori K,Kobayashi N,Atsumi H,et al.Changes in compliance with Japanese antiemetic guideline for chemotherapyinduced nausea and vomiting:a nationwide survey using a distributed research network[J].Support Care Cancer,2014,22(4):969-977.
[4]姜文奇,巴一,冯继锋,等.肿瘤药物治疗相关恶心呕吐防治中国专家共识(2019年版)[J].中国医学前沿杂志(电子版),2019,11(11):16-26.
[5]Cabaleiro T,Lopez-Rodriguez R,Ochoa D,et al.Polymorphisms influencing olanzapine metabolism and adverse effects in healthy subjects[J].Hum Psychopharmacol,2013,28(3):205-214.
[6]Rami-Porta R,Bolejack V,Crowley J,et al.Proposals for the revisions of the T descriptors in the forthcoming eighth edition of the TNM classification for lung cancer[J].J Thorac Oncol,2015,10(7):990-1003.
[7]Wan C,Meng Q,Yang Z,et al.Validation of the simplified Chinese version of EORTC QLQ-C30 from the measurements of five types of in patients with cancer[J].Ann Oncol,2008,19(12):2053-2060.
[8]Ayana BA,Negash S,Yusuf L,et al.Reliability and Validity of Amharic Version of EORTC QLQ-C 30 Questionnaire among Gynecological Cancer Patients in Ethiopia[J].PLoS One,11(6):e0157359.
[9]Nakashima K,Murakami H,Yokoyama K,et al.A phase Ⅱstudy of palonosetron,aprepitant,dexamethasone and olanzapine for the prevention of cisplatin-based chemotherapyinduced nausea and vomiting in patients with thoracic malignancy[J].Jpn J Clin Oncol,2017,47(9):840-843.
[10]Richardson JL,Marks G,Levine A.The influence of symptoms of disease and side effects of treatment on compliance with cancer therapy[J].J Clin Oncol,1988,6(11):1746-1752.
[11]Craig JB,Powell BL.The management of nausea and vomiting in clinical oncology[J].Am J Med Sci,1987,293(1):34-44.
[12]Borison HL,Wang SC.Physiology and pharmacology of vomiting[J].Pharmacol Rev,1953,5(2):193-230.
[13]Seigel LJ,Longo DL.The control of chemotherapy-induced emesis[J].Ann Intern Med,1981,95(3):352-359.
[14]刘雷,丁琛琛,王俊,等.小剂量奥氮平改善女性肺癌患者高致吐性化疗导致的延迟性恶心和呕吐[J].肿瘤学杂志,2017,23(3):251-253.
[15]Yang T,Liu QX,Lu M,et al.Efficacy of olanzapine for the prophylaxis of chemotherapy-induced nausea and vomiting:a meta-analysis[J].Br J Clin Pharmacol,2017,83(7):1369-1379.
[16]Sutherland A,Naessens K,Plugge E,et al.Olanzapine for the prevention and treatment of cancer-related nausea and vomiting in adults[J].Cochrane Database Syst Rev,2018,9(9):CD012555.
[17]Osman AAM,Elhassan MMA,AbdElrahim BHA,et al.Olanzapine for the prevention of chemotherapy-induced nausea and vomiting:A comparative study from Sudan[J].J Glob Oncol,2018,4:1-9.
[18]Shivaprakash G,Karthik S,Sarayu V,et al.Olanzapine versus aprepitant for the prophylaxis of chemotherapy-induced nausea and vomiting in breast cancer patients receiving doxorubicin cyclophosphamide regimen:A prospective,nonrandomized,open-label study[J].Indian J Pharmacol,2017,49(6):451-457.
[19]Tan LJ,Liu JT,Liu XL,et al.Clinical research of Olanzapine for the prevention of chemotherapy-induced nausea and vomiting[J].J Exp Clin Cancer Res,2009,28(1):131-137.
[20]吴锡林,王均惠,陈建新.奥氮平预防非小细胞肺癌化疗顺铂方案所致恶心呕吐[J].肿瘤学杂志,2019,25(3):264-267.
[21]何慧丽,袁东东.乳腺癌联合治疗方案中辅助化疗所致恶心呕吐应用奥氮平的临床疗效分析[J].中国医学工程,2019,27(10):110-112.
[22]何尚香,欧丹贞.奥氮平三联止吐方案对中度致吐化疗患者临床疗效观察[J].深圳中西医结合杂志,2019,29(21):137-138.
Clinical application of Olanzapine in preventing nausea and vomiting caused by chemotherapy in patients with advanced non-small cell lung cancer
WANG Lei WANG Ming-ji
Department of Oncology, Dalian Friendship Hospital, Liaoning Province, Dalian 116001, China
Department of Oncology, Dalian Friendship Hospital, Liaoning Province, Dalian 116001, China
[Abstract]Objective To investigate the clinical effect and safety of Olanzapine in preventing nausea and vomiting caused by chemotherapy in patients with advanced non-small cell lung cancer.Methods A total of 50 patients with advanced non-small cell lung cancer chemotherapy-induced nausea and vomiting in Dalian Friendship Hospital from November 2016 to November 2019 were selected, and they were divided into the observation group (n=25) and the control group (n=25) by the random number table method.Both groups were given Cisplatin combined with Paclitaxel/Docetaxel chemotherapy.Patients in the control group were treated with Ondansetron Hydrochloride Injection preventively,and in the observation group, they were treated with Olanzapine combined with Ondansetron Hydrochloride Injection to stop vomiting.The complete remission rate of nausea and vomiting after chemotherapy was recorded.The quality of life and incidence of adverse reactions between the two groups were compared.Results There was no significant difference in the complete remission rate of acute nausea and acute vomiting between the two groups (P>0.05).The complete remission rates of delayed nausea and delayed vomiting in the observation group were higher than those in the control group, and the differences were statistically significant (P<0.05).The emotional function score on the quality of life scale of the observation group was higher than that of the control group, and the difference was statistically significant(P<0.05).The nausea, vomiting and decreased appetite scores on the quality of life scale of the observation group were lower than those of the control group, and the differences were statistically significant (P<0.05).The incidence of drowsiness and dizziness in the observation group was higher than that in the control group, and the difference was statistically significant (P<0.05).Conclusion Olanzapine has a good effect on preventing delayed nausea and vomiting caused by chemotherapy in patients with advanced nonsmall cell lung cancer, and it can improve the quality of life of patients.
[Key words]Olanzapine;Nausea;Vomiting;Quality of life
[中图分类号]R734
[文献标识码]A
[文章编号]1674-4721(2021)3(b)-0084-05
[作者简介]王雷(1988-),女,辽宁大连人,硕士,主治医师,研究方向:肺癌、乳腺癌及结直肠癌等化疗、靶向治疗、免疫治疗
(收稿日期:2020-05-18)