急性缺血性卒中伴颅内外动脉粥样硬化性狭窄与碱性磷酸酶的关系
杜艳群 王 微 陈 楠 方传勤▲
安徽医科大学第二附属医院神经内科,安徽合肥 230601
[摘要]目的 探讨急性缺血性卒中伴颅内外动脉粥样硬化性狭窄与碱性磷酸酶(ALP)的关系。 方法 回顾性纳入2020年1~6月在安徽医科大学第二附属医院神经内科住院的急性缺血性脑卒中患者,根据头颈部计算机断层血管造影(CTA)检查分组,颅内外动脉狭窄率≥50%者为狭窄组(颅内/颅外动脉粥样硬化性狭窄),狭窄率<50%或无血管狭窄者为对照组(非脑动脉粥样硬化性狭窄)。收集患者人口统计学及基线临床资料,并分析不同碱性磷酸酶水平与颅内外动脉粥样硬化性狭窄发生率的关系; 应用多变量Logistic 回归分析明确颅内外动脉粥样硬化性狭窄的危险因素。 结果 共纳入163 例患者,其中狭窄组72 例,对照组91 例。狭窄组患者的年龄、糖尿病发生率、ALP、空腹血糖、三酰甘油、低密度脂蛋白胆固醇水平均高于对照组,差异有统计学意义(P<0.05)。随着血清ALP 水平的升高,颅内外动脉粥样硬化性狭窄发生率增加(P<0.05)。多变量Logistic 回归分析显示,ALP(OR=1.024,95%CI:1.009~1.039,P=0.002)是颅内外动脉粥样硬化性狭窄的危险因素之一。 结论 血清ALP 水平与缺血性卒中患者颅内外动脉粥样硬化性狭窄有相关性,ALP 在一定程度上可以反映颅内外血管狭窄程度。
[关键词]卒中;动脉粥样硬化;动脉狭窄;碱性磷酸酶;危险因素
卒中是继缺血性心脏病之后的全球第二大死亡原因[1],我国总体卒中终生发病风险为39.9%,位居全球首位,卒中是目前我国成年人群致残的首要病因,其中,我国缺血性卒中发病率表现为持续上升,出血性卒中发病率呈现缓慢下降的趋势[2]。确定急性缺血性脑卒中的病因对于患者的管理至关重要,特别是对于卒中的复发提供有效的二级预防措施,近年来的研究表明颅内外动脉狭窄是缺血性脑卒中发生和发展的普遍原因[3]。
碱性磷酸酶(alkaline phosphatase,ALP)在临床实践中通常用作肝脏或骨骼疾病的标志物,最近的流行病学研究表明,升高的ALP 与冠状动脉和外周动脉粥样硬化的存在、心血管事件的增加及死亡率有关[4-5]。一项最新研究发现,急性缺血性卒中患者的血清ALP浓度升高[6],此外,升高的ALP 水平会增加急性缺血性卒中患者早期死亡的风险[7]。这些研究结果表明,血清ALP 水平升高可能在心脏和大脑的动脉粥样硬化性血管疾病的发展中具有病理生理作用,而关于ALP和脑动脉粥样硬化之间的关系研究较少,且研究结果仍然不确定[8-9]。因此,本研究结合计算机断层血管造影(CTA),旨在探究缺血性卒中伴颅内外动脉粥样硬化性狭窄与ALP 及相关危险因素的联系,现报道如下。
1 资料与方法
1.1 一般资料
回顾性纳入2020年1~6月在安徽医科大学第二附属医院神经内科住院的急性缺血性脑卒中患者。纳入标准:①年龄≥18 岁;②符合《中国急性缺血性脑卒中诊治指南2018》[10]中缺血性卒中的诊断标准;③发病至入院时间≤7 d;④经头颈部CTA 检查,且将颅内或颅外动脉狭窄≥50%作为脑动脉狭窄组判定标准。排除标准:①卒中分型考虑心源性栓塞型、小动脉闭塞型、其他可知原因型(如动脉夹层、肌营养发育不良、烟雾病)及其他不明原因型;②可能影响血清ALP水平的各种疾病,如骨骼系统疾病、乙型肝炎、急慢性肝病、胆管系统疾病、慢性肾功能疾病以及癌症等。
1.2 基线资料
收集所有患者以下临床资料。①人口统计学资料:性别和年龄;②血管危险因素:高血压、糖尿病、高脂血症、吸烟史和饮酒史;③基线实验室生化指标:尿酸、肌酐、胱抑素、ALP、空腹血糖、三酰甘油、总胆固醇、高密度脂蛋白胆固醇、低密度脂蛋白胆固醇。
1.3 影像学评估
所有患者均接受头颈部CTA 检查进行颅内外血管评估,颅内血管定义为大脑前动脉、大脑中动脉、大脑后动脉、颈内动脉的颅内部分、椎动脉的颅内部分和基底动脉,颅内动脉狭窄率计算参考华法林-阿司匹林对症性颅内疾病研究(Warfarin-Aspirin 症状性颅内疾病研究)[11]中公布的方法对颅内动脉狭窄进行评估。颅外动脉包括颈动脉、颈外动脉、颈内动脉的颅外部分、椎动脉的颅外部分和锁骨下动脉,颅外动脉狭窄的程度根据Rothwell 等[12]发表的公式计算得出,脑动脉粥样硬化性狭窄定义为脑动脉明显狭窄或闭塞(≥50%)。
1.4 统计学方法
采用SPSS 22.0 统计学软件进行数据分析,符合正态分布的计量资料用均数±标准差(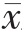 ±s)表示,两组间比较采用独立样本t 检验,不符合正态分布者以中位数四分位数间距[M(IQR)]表示,组间比较采用Mann-Whitney U 检验;计数资料采用率表示,组间比较采用χ2 检验;采用多变量Logistic 回归分析确定缺血性卒中伴颅内外动脉狭窄的危险因素,以P<0.05 为差异有统计学意义。
±s)表示,两组间比较采用独立样本t 检验,不符合正态分布者以中位数四分位数间距[M(IQR)]表示,组间比较采用Mann-Whitney U 检验;计数资料采用率表示,组间比较采用χ2 检验;采用多变量Logistic 回归分析确定缺血性卒中伴颅内外动脉狭窄的危险因素,以P<0.05 为差异有统计学意义。
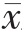 ±s)表示,两组间比较采用独立样本t 检验,不符合正态分布者以中位数四分位数间距[M(IQR)]表示,组间比较采用Mann-Whitney U 检验;计数资料采用率表示,组间比较采用χ2 检验;采用多变量Logistic 回归分析确定缺血性卒中伴颅内外动脉狭窄的危险因素,以P<0.05 为差异有统计学意义。
±s)表示,两组间比较采用独立样本t 检验,不符合正态分布者以中位数四分位数间距[M(IQR)]表示,组间比较采用Mann-Whitney U 检验;计数资料采用率表示,组间比较采用χ2 检验;采用多变量Logistic 回归分析确定缺血性卒中伴颅内外动脉狭窄的危险因素,以P<0.05 为差异有统计学意义。2 结果
研究共纳入163 例患者,经CTA 检查为颅内外动脉狭窄(颅内外动脉狭窄率≥50%)72 例,年龄(65.75±9.97)岁;轻度狭窄(狭窄率<50%)或无颅内外动脉狭窄患者91 例,年龄(61.00±11.94)岁。其中颅内外动脉狭窄率≥50%者作为狭窄组,狭窄率<50%或无狭窄者作为对照组。
2.1 两组患者相关临床资料的比较
狭窄组患者的年龄、糖尿病发生率、ALP、空腹血糖、三酰甘油、低密度脂蛋白胆固醇水平均高于对照组,差异有统计学意义(P<0.05);两组患者的性别、高血压、高脂血症、吸烟、饮酒、尿酸、肌酐、胱抑素、同型半胱氨酸、总胆固醇、高密度脂蛋白胆固醇比较,差异无统计学意义(P>0.05)(表1)。
2.2 不同ALP 水平下颅内外动脉粥样硬化性狭窄情况的比较
根据ALP 四分位数对163 例缺血性卒中患者进行分组,不同ALP 水平的患者,其颅内外血管狭窄发生率比较,差异有统计学意义(P<0.05)(表2)。
2.3 多变量Logistic 回归分析
将表1中差异有统计学意义的年龄、糖尿病、空腹血糖、ALP、三酰甘油、低密度脂蛋白胆固醇作为自变量,颅内外动脉粥样硬化性狭窄作为因变量,进行多变量Logistic 回归分析显示,年龄(OR=1.051,95%CI:1.012~1.091,P=0.009)、糖尿病(OR=3.827,95%CI:1.595~9.181,P=0.003)、ALP(OR=1.024,95%CI:1.009~1.039,P=0.002)、低密度脂蛋白胆固醇(OR=1.883,95%CI:1.193~2.975,P=0.007)是颅内外动脉粥样硬化性狭窄的危险因素(表3)。
表1 两组患者相关临床资料的比较
.jpg)
表2 不同ALP 水平下颅内外动脉粥样硬化性狭窄情况的比较[n(%)]
.jpg)
表3 多变量Logistic 回归分析
.jpg)
3 讨论
ALP 是一种由多基因家族编码的金属酶,广泛分布于原核生物和高级真核细胞中[13],非组织特异性ALP 在某些器官中表达,如肝、肾和骨骼,具有重要的临床诊断意义。由于ALP 通过水解从而使无机焦磷酸盐失活来促进血管钙化[14],被认为是一种血管钙化调节剂,受到国内外研究者的广泛关注。Perticone 等[15]评估500 例高血压患者的血清ALP 水平与内皮功能之间的关系,其研究数据表明ALP 与内皮依赖性血管舒张之间呈强而显著的负相关性。但是,ALP 与亚临床动脉粥样硬化,尤其是颈动脉粥样硬化之间的关系仍然不明确。一项病例对照研究[16]比较了56 名肥胖青少年和58 名对照组,使用单变量分析发现ALP与颈动脉内膜中层厚度之间存在正相关,然而,在调整混杂因素后,ALP 和其他肝酶不再与颈动脉内膜中层厚度相关。相反,另一项包括79 名非洲高血压男性的横断面研究[17]表明,ALP 与颈动脉内膜中层厚度呈正相关。此外,有研究表明血清ALP 水平与冠状动脉粥样硬化性狭窄的发生和发展有关[18],因此,推测脑动脉粥样硬化与血清ALP 可能有相关性。
本研究中,年龄、糖尿病、低密度脂蛋白胆固醇是影响颅内外动脉粥样硬化性狭窄的危险因素,与既往研究结果[19-20]一致。本研究结果还显示,血清ALP 是颅内外动脉粥样硬化性狭窄的危险因素之一,其之间可能存在潜在的机制,但是,目前关于血清ALP 对脑动脉粥样硬化的影响尚存在争议,不同的研究设计和参加者特征可能导致了不同的发现。Lee 等[21]未能找到血清ALP 与大脑动脉狭窄(LCAS)之间的关联,这项研究中使用了严格的LCAS 定义(磁共振血管造影≥50%的狭窄),ALP 调节动脉钙化可能作为动脉粥样硬化疾病的病理基础,这种类型的病变可能在磁共振血管造影上无法准确检测,尤其对于评估颅内动脉,因此,其发现可能低估了血清ALP 对脑动脉粥样硬化的真正影响。本研究采用CTA 对颅内外血管进行评估,这使本研究就血清ALP 与脑动脉粥样硬化之间的相关性得出的结论较为可靠。Ye 等[22]根据参与者的血清ALP 水平将其分为五等级,发现与最低的ALP 五分位数相比,升高的ALP 水平与较高的颈动脉内膜中层厚度值和较高的颅外颈动脉狭窄风险相关,本研究将ALP 水平进行四分位分为4 组,结果提示,随着ALP 水平的升高,颅内外动脉粥样硬化狭窄的发生率增加。与Ye 等[22]的研究结果相一致,即较高的血清ALP 水平,其颅内外动脉粥样硬化性狭窄发生率增高。Uehara 等[9]研究结果表明,血清ALP 水平升高可能是短暂性脑缺血发作患者易患症状性颅内动脉疾病的预测指标,尽管尚不清楚这些发现的确切原因,人们对ALP 与动脉粥样硬化相关的潜在机制了解甚少,但有以下一些合理的解释。①血管钙化机制:ALP 的过度表达会引起血管和其他部位的异位钙化[23],而血管钙化会导致动脉粥样硬化,最终导致一系列缺血性变化。②炎症机制:当身体严重感染如败血症时,ALP 水平会升高,与C 反应蛋白(CRP)类似,ALP 也反映人体的炎症状态[24],体外研究在不同的细胞系也表现出ALP 和炎症介质(特别是肿瘤坏死因子)之间的关联[25]。本研究未评估CRP 或高敏感性CRP,因此无法研究炎症与动脉粥样硬化之间的关系。但是,先前的研究表明,高敏感性CRP 会增加动脉粥样硬化的风险[26]。
除传统的年龄、糖尿病、低密度脂蛋白胆固醇因素外,血清ALP 水平与颅内外动脉狭窄也具有相关性,随着ALP 水平的升高,颅内外动脉粥样硬化性狭窄的发生率增加,或可作为标志物用于快速诊断和预测颅内外大动脉狭窄程度,从而采取更有针对性的检查及治疗。然而本研究尚有不足之处,首先,本研究为回顾性研究,样本量不足,而且未通过全脑血管造影术进一步证实ALP 与颅内外血管狭窄的关系。其次,临床数据是在卒中后收集的,本研究没有在卒中前收集信息,卒中可能会影响基线时的ALP 水平,尽管对传统的危险因素进行了调整,但很可能仍然存在残留的混杂因素。第三,入院后24 h 内检查血清ALP,本研究没有进行连续监测,动态观察长期ALP 的变化值或许更具有意义。
[参考文献]
[1]GBD 2015 Neurological Disorders Collaborator Group.Global,regional,and national burden of neurological disorders during 1990-2015:a systematic analysis for the Global Burden of Disease Study 2015[J].Lancet Neurol,2017,16(11):877-897.
[2]《中国脑卒中防治报告》编写组.《中国脑卒中防治报告2019》概要[J].中国脑血管病杂志,2020,17(5):272-281.
[3]Powers WJ,Rabinstein AA,Ackerson T,et al.Guidelines for the Early Management of Patients With Acute Ischemic Stroke:2019 Update to the 2018 Guidelines for the Early Management of Acute Ischemic Stroke:A Guideline for Healthcare Professionals From the American Heart Association/American Stroke Association[J].Stroke,2019,50(12):e344-e418.
[4]Wannamethee SG,Sattar N,Papcosta O,et al.Alkaline phosphatase,serum phosphate,and incident cardiovascular disease and total mortality in older men[J].Arterioscler Thromb Vasc Biol,2013,33(5):1070-1076.
[5]Ellam TJ,Chico TJ.Phosphate:the new cholesterol?The role of the phosphate axis in non-uremic vascular disease[J].Atherosclerosis,2012,220(2):310-318.
[6]Liu Y,Liang X,Xu X,et al.Increased Serum Alkaline Phosphatase in Patients with Acute Ischemic Stroke[J].J Stroke Cerebrovasc Dis,2019,28(1):21-25.
[7]Shimizu Y,Imano H,Ohira T,et al.Alkaline phosphatase and risk of stroke among Japanese:the Circulatory Risk in Communities Study (CIRCS)[J].J Stroke Cerebrovasc Dis,2013,22(7):1046-1055.
[8]Kim J,Song TJ,Song D,et al.Serum alkaline phosphatase and phosphate in cerebral atherosclerosis and functional outcomes after cerebral infarction[J].Stroke,2013,44(12):3547-3549.
[9]Uehara T,Ohara T,Minematsu K,et al.Predictors of Stroke Events in Patients with Transient Ischemic Attack Attributable to Intracranial Stenotic Lesions[J].Intern Med,2018,57(3):295-300.
[10]中华医学会神经病学分会,中华医学会神经病学分会脑血管病学组.中国急性缺血性脑卒中诊治指南2018[J].中华神经科杂志,2018,51(9):666-682.
[11]Samuels OB,Joseph GJ,Lynn MJ,et al.A standardized method for measuring intracranial arterial stenosis[J].AJNR Am J Neuroradiol,2000,21(4):643-646.
[12]Rothwell PM,Eliasziw M,Gutnikov SA,et al.Analysis of pooled data from the randomised controlled trials of endarterectomy for symptomatic carotid stenosis[J].Lancet,2003,361(9352):107-116.
[13]Buchet R,Millán JL,Magne D.Multisystemic functions of alkaline phosphatases[J].Methods Mol Biol,2013,1053:27-51.
[14]Harmey D,Hessle L,Narisawa S,et al.Concerted regulation of inorganic pyrophosphate and osteopontin by akp2,enpp1,and ank:an integrated model of the pathogenesis of mineralization disorders[J].Am J Pathol,2004,164(4):1199-1209.
[15]Perticone F,Perticone M,Maio R,et al.Serum alkaline phosphatase negatively affects endothelium-dependent vasodilation in na ve hypertensive patients[J].Hypertension,2015,66(4):874-880.
ve hypertensive patients[J].Hypertension,2015,66(4):874-880.
 ve hypertensive patients[J].Hypertension,2015,66(4):874-880.
ve hypertensive patients[J].Hypertension,2015,66(4):874-880.[16]Man E,Cheung PT,Cheung YF.Associations between arterial structure and function and serum levels of liver enzymes in obese adolescents[J].J Paediatr Child Health,2017,53(7):691-697.
[17]Schutte R,Huisman HW,Malan L,et al.Alkaline phosphatase and arterial structure and function in hypertensive African men:the SABPA study[J].Int J Cardiol,2013,167(5):1995-2001.
[18]Martins MJ,Azevedo I.Let′s think in alkaline phosphatase at heart function[J].Int J Cardiol,2010,144(2):333-334.
[19]Lai YJ,Hsu CY.Is serum uric acid a predictive factor for stroke in men with hypertriglyceridemia?[J].Bratisl Lek Listy,2019,120(4):316-319.
[20]Song B,Liu K,Gao Y,et al.Gender-Specific Relationship BetweenUricAcidLevelsandPrognosisAfterCerebralVenous Thrombosis[J].Curr Neurovasc Res,2018,15(4):292-297.
[21]Lee HB,Kim J,Kim SH,et al.Association between Serum Alkaline Phosphatase Level and Cerebral Small Vessel Disease[J].PLoS One,2015,10(11):e0143355.
[22]Ye YC,Liu HM,Zhou Y,et al.Association between Serum Alkaline Phosphatase and Carotid Atherosclerosis in a Chinese Population:A Community-based Cross-sectional Study[J].Biomed Environ Sci,2019,32(6):446-453.
[23]Lomashvili KA,Garg P,Narisawa S,et al.Upregulation of alkaline phosphatase and pyrophosphate hydrolysis:potential mechanism for uremic vascular calcification[J].Kidney Int,2008,73(9):1024-1030.
[24]Mitaki S,Nagai A,Oguro H,et al.C-reactive protein levels are associated with cerebral small vessel-related lesions[J].Acta Neurol Scand,2016,133(1):68-74.
[25]Aghagolzadeh P,Bachtler M,Bijarnia R,et al.Calcification of vascular smooth muscle cells is induced by secondary calciprotein particles and enhanced by tumor necrosis factor-α[J].Atherosclerosis,2016,251:404-414.
[26]Razban MM,Eslami M,Bagherzadeh A.The relationship between serum levels of hs-CRP and coronary lesion severity[J].Clujul Med,2016,89(3):322-326.
Relationship between acute ischemic stroke with intracranial/extracranial atherosclerotic stenosis and alkaline phosphatase
DU Yan-qun WANG Wei CHEN Nan FANG Chuan-qin▲
Department of Neurology, the Second Affiliated Hospital of Anhui Medical University, Anhui Province, Hefei 230601,China
Department of Neurology, the Second Affiliated Hospital of Anhui Medical University, Anhui Province, Hefei 230601,China
[Abstract]Objective To explore the relationship between acute ischemic stroke with intracranial/extracranial atherosclerotic stenosis and alkaline phosphatase (ALP).Methods Patients with acute schemic stroke admitted to the Department of Neurology, the Second Affiliated Hospital of Anhui Medical University from January to June 2020 were enrolled retrospectively.According to the head and neck computed tomography angiography (CTA) examination, those with a stenosis rate of intracranial/extracranial arteries ≥50% were classified as the stenosis group (intracranial/extracranial atherosclerotic stenosis), and those with a stenosis rate <50% or without vascular stenosis were classified as the control group (non-cerebral atherosclerosis stenosis).The demographic data and baseline clinical data were collected, and the correlation between different alkaline phosphatase levels and the incidence of intracranial/extracranial atherosclerotic stenosis was analyzed.The multivariate Logistic regression analysis was used to analyze the influencing factors of intracranial/extracranial atherosclerosis in patients with acute ischemic stroke.Results A total of 163 patients were enrolled, including 72 cases in the stenosis group, 91 cases in the control group.The age, incidence of diabetes,ALP, fasting blood glucose, triglycerides, and low-density lipoprotein cholesterol levels of the stenosis group were higher than those of the control group, the differences were statistically significant (P<0.05).With the increase of serum ALP level, the incidence of intracranial/extracranial atherosclerotic stenosis gradually increased (P<0.05).Multivariate Logistic regression analysis indicated that serum ALP level was one of the risk factors for intracranial/extracranial atherosclerotic stenosis in ischemic stroke patients (OR=1.024, 95%CI: 1.009-1.039, P=0.002).Conclusion The serum ALP level is associated with intracranial/extracranial atherosclerotic stenosis in patients with ischemic stroke, and ALP can reflect the degree of intracranial/extracranial atherosclerotic stenosis to some extent.
[Key words]Stroke; Atherosclerosis; Arterial stenosis;Alkaline phosphatase; Risk factors
[中图分类号]R743.31
[文献标识码]A
[文章编号]1674-4721(2021)4(b)-0008-05
[作者简介]杜艳群(1995-),女,汉族,安徽阜阳人,安徽医科大学2018 级在读硕士研究生,研究方向:脑血管病
▲通讯作者
(收稿日期:2020-10-20)