NF-κB/COX-2信号通路在宫颈癌中的作用及机制研究
黄 晶1 潘宜云2 钟金平1 余 瑛1 廖振蓉1 周茂华3 黄 刚3 刘联斌3▲
1.江西省赣州市肿瘤医院妇瘤科,江西赣州 341000;2.江西省赣州市肿瘤医院化疗科,江西赣州 341000;3.江西省赣州市肿瘤医院检验科,江西赣州 341000
[摘要]目的 探讨敲减环氧合酶2(COX-2)对宫颈癌Hela细胞系生物学特性的影响及潜在机制。方法 构建稳定转染shRNA-COX-2的宫颈癌Hela细胞,通过CCK-8法检测细胞增殖能力、克隆形成法检测细胞克隆能力、流式细胞术检测细胞凋亡及Transwell 检测细胞迁移能力,观察敲减COX-2表达后对细胞生物学功能的影响;通过Western Blot检测p65、p-p65蛋白的表达。结果 转染shRNA COX-2 诱导p65及p-p65表达下调,并降低Hela细胞增殖、克隆形成及迁移能力。结论 下调COX-2可能通过调控NF-κB 信号通路抑制宫颈癌Hela细胞的恶性生物学特性,从而抑制宫颈癌细胞的生长。
[关键词]宫颈癌;Hela细胞;增殖;克隆形成;质粒
宫颈癌在全世界妇女恶性肿瘤中位居第二,发病率呈逐年上升趋势,年新发病人数约53万,主要发生在发展中国家,西方发达国家宫颈癌发病率的下降得益于宫颈癌筛查的普及[1]。我国宫颈癌约以7.3%速率增长,由于筛查普及不足,多数患者确诊时已属于晚期,治疗效果差,严重威胁生命健康[2]。早期发现及诊断是宫颈癌治疗的关键,宫颈癌前病变及发生发展与人乳头瘤病毒(human papillomavirus,HPV)持续感染密切相关[3]。炎症因子核因子κB(nuclear factor κB,NF-κB)、环氧合酶(cyclooxygenase,COX-2)在慢性炎症和致癌通路中发挥重要作用 [4]。研究指出下降NF-κB 的DNA 结合活性,减少COX-2 蛋白表达可预防肿瘤的出现[5]。NF-κB、COX-2 在宫颈癌的作用尚不明确,本研究旨在探讨NF-κB/COX-2信号通路在宫颈癌中的作用及潜在机制,以期为宫颈癌的诊断和治疗提供新的靶标,现报道如下。
1 材料与方法
1.1 细胞与主要试剂
人宫颈癌Hela细胞系购自中科院上海细胞库;慢病毒载体pLenR-GPH、病毒包装辅助质粒pRsv-REV,pMDlg-pRRE,pMD2G,Transfer Vector、293T细胞、大肠埃希菌菌株DH5α、dsDNA oligo 购自Beyotime公司;限制性内切酶购自Takara公司;胎牛血清(FBS)(批号:10270-106)、DMEM 培养基(批号:C11995)购自美国Gbico公司;兔抗COX-2(批号:ab120295)购自美国Abcam公司;p65(批号:PA141573)、p-p65(批号:AF2006)购自Affinity公司;羊抗鼠/兔二抗(批号:F2761)购自美国Gibco公司;大提质粒试剂盒购自美国Qiagen公司;LipofectaminTM 2000、胰蛋白酶、Trizol、SYBR 购自美国Invitrogen公司;Annexin V-APC凋亡试剂盒购自美国eBioscience 美国公司;流式细胞仪(Guava easyCyte HT)购自美国密理博公司。
1.2 实验分组
未转染的Hela细胞作为对照(Hela组),转染RNAi阴性对照Scramble 的为NC组,此外3组shRNA COX-2稳定转染的Hela细胞分别为Sh1、Sh2及Sh3组,选择其中敲减效率最高的为KD组。
1.3 实验方法
1.3.1 RNAi 慢病毒载体构建及慢病毒病毒转染Hela细胞根据Genebank 中COX-2 序列(PTGS-2,NM_000963)为模板选择3 段靶序列:RNAi(1)5′-GCTGAATTTAACACCCTCTAT-3′、RNAi(2)5′-CCATTCT CCTTGAAAGGACTT-3′、RNAi(2)5′-CCGGAATTTTT GACAAGAA-3′。同时设计RNAi 阴性对照Scramble序列:5′-TTCTCCGAACGTGTCACGT-3′。再根据以上3 段序列设计寡核苷酸序列,该序列中插入Age I、EcoR I 酶切位点,每对寡核苷酸序列退火后可形成短发夹结构,其中发夹环为19个碱基组成的小片段DNA 双链(表1)。聚合酶链式反应(PCR)鉴定阳性重组子后,送上海领科生物科技有限公司进行测序验证。利用慢病毒载体包装系统,然后共转染293T细胞,转染后8 h 然后继续培养48 h后,收集细胞上清液。取对数生长期的Hela细胞,以5×104cell/孔接种于6孔板中,置入37℃5%CO2 培养箱培养。细胞融合度达到约30%后加入适宜量的病毒,12 h后观察细胞状态:如果没有明显的细胞毒性作用,继续培养24 h后更换培养基;如果有明显的细胞毒性作用,立即更换培养基,感染3 d后荧光显微镜下观察绿色荧光蛋白的表达。
1.3.2 Western Blot检测蛋白表达 收集慢病毒转染96 h 的Hela细胞,提取蛋白并测定浓度。恒流300 mA 150 min条件下湿转法转膜。室温下封闭1 h,加入TBST 稀释的COX-2(Abcam,1∶1000),p65(Abcam,1∶1000),p-p65(Abcam,1∶1000),4℃震荡孵育过夜、TBST 洗涤后,加入二抗室温孵育2 h。充分洗涤后通过ECL 化学发光进行曝光。采用Image J 软件计算灰度值。
表1 寡核苷酸序列表
.jpg)
1.3.3 CCK-8 实验检测细胞增殖能力 取对数生长期的各组细胞制备成细胞悬液,计数细胞后种入96孔板细胞密度(约2000个/孔),每组3~5个负孔,共5个96孔板,连续检测5 d,置入37℃5%CO2培养箱培养。从铺板后第2天开始,培养终止前24 h,每孔加入10 μl 的CCK-8,无需换液,注意尽量避免吹入气泡,2~4 h后,振荡器振荡5~10 min,立即酶标仪450 nm检测OD值,如果空中出现影响测量结果的气泡,用烧热的注射器针头戳破,对数据进行统计绘图。
1.3.4 Transwell 实验检测细胞迁移能力 Transwell小室上加入100 μl 细胞悬液,下室加入600 μl 30%FBS 培养基。37℃培养箱培养,Giemsa 染色液染色转移细胞,空气晾干,显微镜拍照。
1.3.5 流式细胞仪检测细胞凋亡 收集悬浮细胞离心(2000 r/min离心5 min),用PBS洗涤细胞2次(2000 r/min离心5 min)收集1.5×105 细胞,加入500 μl的Binding Buffer 悬浮细胞;加入5 μl Annexin V-FITC混匀后,加入5 μl Propidium Iodide,混匀;室温、避光、反应5~15 min;在1 h 内,进行流式细胞仪的观察和检测。
1.4 统计学方法
采用IBM SPSS 22.0 统计学软件进行数据分析,计量资料用均数±标准差(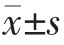 )表示,多组间比较采用单因素方差分析,两组间比较采用t检验,以P<0.05为差异有统计学意义。
)表示,多组间比较采用单因素方差分析,两组间比较采用t检验,以P<0.05为差异有统计学意义。
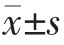 )表示,多组间比较采用单因素方差分析,两组间比较采用t检验,以P<0.05为差异有统计学意义。
)表示,多组间比较采用单因素方差分析,两组间比较采用t检验,以P<0.05为差异有统计学意义。2 结果
2.1 构建shRNA-COX-2稳定转染的Hela细胞
构建三组shRNA-COX-2稳定转染的Hela细胞,Western Blot检测各组COX-2的表达,结果显示,Sh1、Sh2及Sh3组的COX-2表达均低于Hela组及NC组 (P<0.05);NC组与Hela组的COX-2比较,差异无统计学意义(t=2.721,P>0.05)。根据敲减结果选择Sh3组作为后续实验细胞株(图1)。
.jpg)
图1 构建shRNA-COX-2稳定转染的Hela细胞
2.2 敲减COX-2表达对Hela细胞增殖、克隆能力的影响
通过CCK-8法检测敲减COX-2表达对Hela细胞增殖能力的影响,结果显示,生长72 h时KD组的增殖能力低于NC组,差异有统计学差异(P<0.05);生长96 h时差异更为明显(P<0.05)(图2A);敲减COX-2表达后,KD组克隆细胞克隆形成能力低于NC组,差异有统计学差异(t=4.871,P<0.05)(图2B)。
.jpg)
图2 敲减COX-2表达对Hela细胞增殖、克隆能力的影响
2.3 敲减COX-2表达对Hela细胞凋亡与迁移能力的影响
通过Transwell 法检测Hela细胞迁移能力,结果显示,KD组的细胞迁移能力明显低于NC组,差异有统计学意义 (P<0.001);NC组与Hela组的细胞迁移能力比较,差异无统计学意义(P>0.05)(图3A)。通过Annexin V-PI 法检细胞凋亡情况,结果显示,敲减COX-2表达后,KD组与NC组的细胞凋亡率比较,差异无统计学意义(t=0.997,P>0.05)(图3B)。
.jpg)
图3 敲减COX-2表达对Hela细胞凋亡与迁移能力的影响
.jpg)
图4 敲减COX-2表达对Hela细胞NF-κB通路的影响
2.4 敲减COX-2表达对Hela细胞NF-κB通路的影响
Western Blot检测NF-κB通路相关蛋白p65及p-p65的表达,当敲减Hela细胞COX-2表达后,KD组的COX-2、p65及p-p65表达均低于NC组,差异有统计学意义(P<0.001)(图4)。
3 讨论
HPV 持续感染是宫颈癌病变的重要原因,HPV DNA 整合发生于宫颈病变早期,病毒致癌基因E6和E7活化,E2抑制内源性E6基因表达并诱导宫颈细胞肿瘤坏死因子-α (TNF-α) 介导的NK-κB激活[6]。NF-κB通路不仅是炎症反应的关键信号,其异常活化可导致哮喘、肠炎及多种肿瘤疾病的发生。此外,NF-κB通路在宿主的先天性和适应性免疫反应中发挥重要作用[7]。早期病变时,NF-κB 的激活抑制HPV持续感染状态。在发展成高度上皮内瘤变和宫颈癌的进程中,发挥协同作用促进病变[8-9]。实体瘤中NF-κB自身基因突变少见,但上游信号分子(如RAS、EGFR、PGF、HER2) 的突变与活化NF-κB 信号传导有关[10]。NF-κB可以通过端粒酶调控增殖调节基因,如cyclin D1和c-myc,参与细胞恶性转移、血管内皮生长因子(VEGF)依赖性的血管生成和细胞永生基因的转录激活[11-12]。NF-κB 激活还可以诱导激活胞嘧啶脱氨酶和APOBEC 蛋白的表达,进而间接或直接参与宫颈癌的发生[13]。
COX-2作为前列腺素E2 合成通路上的关键酶,在细胞凋亡、血管生成、免疫抑制及细胞迁移等过程中发挥重要作用,与宫颈癌发生进展密切相关[14]。COX-2的活性受到NF-κB 的调节,在非小细胞癌中,NF-κB 激活上调COX-2的表达[15]。前列腺素E2 的抑制剂hyaluronan抑制白介素-1(IL-1)诱导的NF-κB活性,前列腺素E2表达和NF-κB 活性相关[16]。NF-κB调控多种涉及转移侵袭的基因表达,包括基质金属蛋白酶9(MMP9)和VEGF,MMP9 参与基质胶原降解进而影响了癌细胞转移和侵袭,激活NF-κB 信号可以诱导MMP9表达促进细胞侵袭[17-18]。最近研究显示姜黄素可以通过下降NF-κB 的DNA 结合活性,减少COX-2 蛋白来调控癌细胞的增殖与凋亡[19-20]。
本研究通过构建稳定表达shRNA-COX-2的Hela细胞,敲减COX-2表达后观察对Hela细胞生物学功能的影响,结果显示,敲减COX-2后显著抑制宫颈癌Hela细胞的增殖、克隆形成及迁移能力,但并未明显影响Hela细胞凋亡能力,提示COX-2是Hela细胞恶性表型的关键基因。进一步探究COX-2的调控作用,抑制p65及p-p65表达,介导NF-κB 信号通路发挥作用。但NF-κB/COX-2信号通路如何在宫颈癌Hela细胞中发挥关键作用,具体上下游调控机制有待于更深入的研究。
综上所述,下调COX-2可能通过NF-κB通路抑制宫颈癌Hela细胞的增殖、克隆能力,并降低细胞的侵袭迁移作用,有利于深入了解其作用机制,为宫颈癌的精准个体化治疗提供方向。
[参考文献]
[1]Small W,Bacon MA,Bajaj A,et al.Cervical Cancer:A Global Health Crisis[J].Cancer,2017,123(13):2404-2412.
[2]Gu XY,Zheng RS,Sun KX,et al.Incidence and mortality of cervical cancer inChina,2014[J].Zhonghua Zhong Liu Za Zhi,2018,40(4):241-246.
[3]Tranberg M,Bech BH,Blaak RJ,et al.Preventing cervical cancer using HPV self-sampling:direct mailing of test-kits increases screening participation more than timely opt-in procedures-A randomized controlled trial[J].BMC Cancer,2018,18(1):273.
[4]Li B,Li X,Xiong H,et al.Inhibition of COX2 enhances the chemosensitivity of dichloroacetate in cervical cancer cells[J].Oncotarget,2017,8(31),125-129.
[5]Liu H,Li G,Zhang B,et al.Suppression of the NF-κB Signaling Pathway in Colon Cancer Cells by the Natural Compound Riccardin D From Dumortierahirsute[J].Mol Med Rep,2018,17(4),5837-5843.
[6]Kessler AT.Cervical Cancer:Prevention and Early Detection[J].Semin Oncol Nurs,2017(33),172-183.
[7]Rodríguez AC,Avila C,Herrero R,et al.Cervical cancer incidence after screening with HPV,cytology,and visual methods:18-year follow-up of the Guanacaste cohort[J].Int J Cancer,2017,140(8):1926-1934.
[8]陈建翠,姜琦.下调IRAK1 基因调控NF-κB 信号通路抑制宫颈癌细胞生长的机制研究[J].免疫学杂志,2019,13(7):587-591.
[9]Morales-Campos DY,Snipes SA,Villarreal EK,et al.Cervical cancer,human papillomavirus (HPV),and HPV vaccination:exploring gendered perspectives,knowledge,attitudes,and cultural taboos among Mexican American adults[J].Ethnic Health,2018,12:1-19.
[10]Li P,Tan Y,Zhu LX,et al.Prognostic Value of Hpv DNA Status in Cervical Cancer before Treatment:A Systematic Review and Meta-Analysis[J].Oncotarget,2017,8(39):66 352-66 359.
[11]Anayannis NV,Schlecht NF,Bendayan M,et al.Association of an intact E2 gene with higher HPV viral load,higher viral oncogene expression,and improved clinical outcome in HPV16 positive head and neck squamous cell carcinoma[J].PLoS One,2018,13(2):e0191581.
[12]Long L,Pang X X,Lei F,et al.Slc52a3 Expression Is Activated by NF-κB p65/Rel-B and Serves as a Prognostic Biomarker in Esophageal Cancer[J].Cell Mol Life Sci,2018,75(14):2643-2661.
[13]Ma L,Feng L,Ding X,et al.Effect of TLR4 on the growth of SiHa human cervical cancer cells via the MyD88-TRAF6-TAK1 and NF-κB-cyclin D1-STAT3 signaling pathways[J].Oncol Lett,2018,15(3):3965-3970.
[14]Yu X,Liu Y,Wang Y,et al.Baicalein Induces Cervical Cancer Apoptosis through the NF-κB Signaling Pathway[J].Mol Med Rep,2018,17(4):5088-5094.
[15]Clark BL,Murphy MA,Kamdem LK.COX2 Induction:A Mechanism of Endocrine Breast Cancer Resistance?[J].Breast Cancer Res Treat,2017,165(2):383-389.
[16]Dong J,Li J,Cui L,et al.Cortisol Modulates Inflammatory Responses in Lps-Stimulated Raw264.7 Cells Via the NFκB and MAPK Pathways[J].BMC Vet Res,2018,14(1):30.
[17]Choi YH,Back KO,Kim HJ,et al.Pirfenidone Attenuates IL-1β-induced COX-2 and PGE2 Production in Orbital Fibroblasts Through Suppression of NF-κB Activity[J].Exp Eye Res,2013,113:1-8.
[18]Zhang JF,Wang P,Yan YJ,et al.IL-33 Enhances Glioma Cell Migration and Invasion by Upregulation of MMP2 and MMP9 via the ST2-NF-κB Pathway[J].Oncol Rep,2017,38(4):2033-2042.
[19]唐艳,杨蓉佳,陈红纲,等.姜黄素对百草枯中毒致肺纤维化大鼠肺功能及TGF-β1、NF-κB表达的影响[J].中华急诊医学杂志,2017,26(4):392-395.
[20]Sun Y,Dai H,Chen S,et al.Graphene oxide regulates cox2 in human embryonic kidney 293T cells via epigenetic mechanisms:dynamic chromosomal interactions[J].Nanotoxicology,2018,12(7):117-137.
Study on the effect and mechanism of NF-κB/COX-2 signaling pathway in cervical cancer
HUANG Jing1 PAN Yi-yun2 ZHONG Jin-ping1 YU Ying1 LIAO Zhen-rong1 ZHOU Mao-hua3 HUANG Gang3 LIU Lian-bin3▲
1.Department of Gynecological Tumor, Ganzhou Cancer Hospital, Jiangxi Province, Ganzhou 341000, China;2.Department of Chemotherapy, Ganzhou Cancer Hospital, Jiangxi Province, Ganzhou 341000, China;3.Department of Clinical Laboratory, Ganzhou Cancer Hospital, Jiangxi Province, Ganzhou 341000, China
[Abstract]Objective To investigate the effect and potential mechanism of knocking down cyclooxygenase 2 (COX-2)on the biological characteristics of cervical cancer Hela cell line.Methods Cervical cancer Hela cells stably transfected with shRNA-COX-2 were constructed.Cell proliferation ability was detected by the CCK-8 method, cell cloning ability was detected by the clone formation method, apoptosis was detected by flow cytometry and cell migration ability was detected by Transwell.The effect of knocking down COX-2 expression on cell biological function was observed.The expression of p65 and p-p65 proteins was detected by Western Blot.Results Transfection of shRNA COX-2 induced the down-regulation of p65 and p-p65 expression, and reduced the proliferation, clonal formation and migration ability of Hela cells.Conclusion Down-regulation of COX-2 may inhibit the malignant biological characteristics of cervical cancer Hela cells by regulating the NF-κB signaling pathway, thereby inhibiting the growth of cervical cancer cells.
[Key words]Cervical cancer;Hela cells;Proliferation;Clonal formation;Plasmids
[中图分类号]R737.33
[文献标识码]A
[文章编号]1674-4721(2020)7(b)-0004-05
[基金项目]江西省自然科学基金计划项目(20142BAB205053)
[作者简介]黄晶(1977-),女,江西会昌人,本科,副主任医师,研究方向:妇科肿瘤的诊治
▲通讯作者:刘联斌(1974-),男,江西于都人,本科,主任技师,研究方向:临床检验
(收稿日期:2020-01-16)