替芬泰片在健康人体的耐受性及药代动力学分析
梁 弘 李 洁 吴玉春 程 楠 陈华容 吴贵辉▲
贵州百灵企业集团制药股份有限公司学术研发部,贵州安顺 561000
[摘要]目的 分析替芬泰片在健康人体的耐受性及其药代动力学。方法 本研究采用随机、双盲的方法于2017年1?6月纳入的26例健康志愿者作为研究对象,所有患者给予300、600 mg 替芬泰,两种剂量分别单、多次给药,多次给药为给药1次/d,连续给药7 d,其中药物洗脱周期为2周。采用高效液相色谱法检测不同时间点的药代动力学参数[最高血药浓度(Cmax)、最低血药浓度(Cmin)、平均血药浓度(Cavg)、一段时间内的血药浓度曲线面积(AUC0-t)、无穷远的血药浓度曲线面积(AUC0?∞)、积累指数];分析药代动力学参数、高效液相色谱特征及相关不良反应。结果 健康志愿者多次口服不同剂量的替芬泰片后,替芬泰的达峰时间(Tmax)为(1.02±0.13)h,半衰期(t1/2)为(3.08±0.09)h;M8的Tmax为(3.05±0.07)h,t1/2约为(9.56±0.67)h;M9的Tmax 为(4.11±0.15)h,t1/2为(6.17±0.21)h。300 mg 给药剂量下,替芬泰多次给药与单次给药的Cmax、Cmin、Cavg、AUC0-t、AUC0-∞、积累指数比较,差异无统计学意义(P>0.05);代谢物N-苯甲酰基-O-(二甲氨基乙基)-L-酪氨酸(简称M8)和代谢物N-苯甲酰基-L-酪氨酸-O-(N-氧化-二甲氨基乙基)-L-酪氨酸(简称M9)多次给药的AUC0-t和AUC0-∞高于单次给药,差异有统计学意义(P<0.05);M9 多次给药的Cmax高于单次给药,差异有统计学意义(P<0.05)。600 mg 给药剂量下,替芬泰多次给药的Cmax高于单次给药,差异有统计学意义(P<0.05);替芬泰多次给药与单次给药的Cmin、Cavg、AUC0?t、AUC0-∞、积累指数比较,差异无统计学意义(P>0.05);M8和M9 多次给药的Cmax和AUC0-t高于单次给药,差异有统计学意义(P<0.05);M9 多次给药的AUC0?∞高于单次给药,差异有统计学意义(P<0.05)。600 mg 给药剂量下,多次给药使替芬泰Cmax升高,对其暴露量AUC0?∞没有显著影响;代谢物M8和M9的Cmax增高,同时暴露量AUC0-∞增加。健康志愿者多次口服(剂量300、600 mg)替芬泰片后,600 mg 剂量时1例志愿者发生了1次轻度咽喉部不适,有异物感的不良事件,判定为与药物无关,无志愿者因不良事件退出试验。结论 替芬泰片600 mg 仍未表现出明显的蓄积作用,安全性高,为了取得较好的抗病毒效果,可建议每日参考剂量为600 mg。
[关键词]替芬泰片;健康人体;不良反应;药代动力学
有数据显示,我国普通人群乙肝表面抗原(HBsAg)阳性率为9.09%[1],可见我国乙型肝炎患者数量众多,若疾病控制不当,可能逐步进展为肝硬化、肝癌、肝衰竭等疾病,严重威胁着患者的生命安全[2-5]。目前临床上常用核苷类药物和干扰素治疗乙肝,但此类药物均存在效果不佳或价格昂贵等不足[6-10]。因此,新药的研发或新的治疗方法对临床治疗乙肝具有重要意义。替芬泰是从苗药马蹄金中分离制得的二肽衍生物[11],具有与其他核苷类药物不同的抗病毒机制,主要是通过诱导机体的免疫反应发挥抗病毒的作用[12]。研究显示,替芬泰具有较好的抗乙肝病毒(HBV)的作用,同时细胞毒副作用轻,不易出现耐药性,且使用后不易出现停药反跳现象等优势,有广泛的应用前景[13-14]。动物实验显示,个体间对替芬泰的生物利用度存在较大的差异,可能与外排转运体P-糖蛋白、人结肠腺癌细胞的功能和形态等因素有关,但健康人体的不良反应及药代动力学报道较少。本研究旨在分析替芬泰片在健康人体的耐受性及其药代动力学,为其临床应用提供数据支持及理论依据,现报道如下。
1 材料与方法
1.1 药品与仪器
替芬泰片(批号:20140106)是由贵州省中国科学院天然产物化学重点实验室合成的纯度为99%的药物。采用Waters 2695型高效液相色谱仪(美国沃特世公司),Waters 996型二极管阵列检测器(美国沃特世公司)。
1.2 志愿者一般资料
本研究采用随机、双盲的方法于2017年1?6月纳入26例健康志愿者作为研究对象,其中男13例,女13例;年龄22?60岁,平均(36.52±6.68)岁。26例健康志愿者,其中2例为预实验,24例为正式实验。纳入标准:①年龄20?60岁者;②生理各项指标正常者。排除标准:①妊娠期或哺乳期女性;②对替芬泰片中的药物相关成分过敏者;③过敏体质者。本研究经医院医学伦理委员会审核批准,健康志愿者在完全阅读并清楚研究内容及相关事项的基础上,签署知情同意书。
1.3 志愿者给药方法及血样采集
预实验人群采用替芬泰的剂量为300 mg 单、多次给药,多次给药为给药1次/d,连续给药7 d,正式实验为300 mg和600 mg 分别单、多次给药,多次给药同预实验,其中药物洗脱周期为2周。
单次给药期间,于第1 天服药前和服药后15、30、45 min,1、1.5、2、2.5、3、4、5、6、8、12、24、36、48 h 采集血浆样品,于前臂静脉分别采集静脉血4 ml;多次给药期间,于第7、8、9 天服药前和第9 天服药后15、30、45 min,1、1.5、2、2.5、3、4、5、6、8、12、24、36、48 h采集血浆样品,于前臂静脉分别采静脉血4 ml。血样采集后移入EDTA 抗凝管中,4℃离心5 min(3500 r/min),分离血浆,于-70℃以下冷冻保存待测。
1.4 色谱条件及血清中替芬泰及其代谢产物的检测
色谱条件:参照2010版《中国药典》[15]有关物质的测定方法,采用高效液相色谱-紫外检测器进行测定。色谱柱:RP-18(ID=250 mm×4.6 mm),测定法:流动相为甲醇-0.1%三乙胺水溶液(用稀磷酸调pH值为8.0)=65∶35。流速:1.0 ml/min;荧光检测波长为340 nm;柱温:30℃;进样量20 μl。Varian 9010型三元泵(美国瓦里安公司),VarianⅡ型荧光检测器(美国瓦里安公司),数据处理软件为Varian 系统。
抽取受试者4 ml 外周血,离心处理,采用高效液相色谱仪进行血药浓度的相关检测,检测内容包括替芬泰及替芬泰代谢产物N-苯甲酰基-O-(二甲氨基乙基)-L-酪氨酸(简称M8)和代谢物N-苯甲酰基-L-酪氨酸-O-(N-氧化-二甲氨基乙基)-L-酪氨酸(简称M9)。系统适应性试验:取供试品溶液进样,理论板数按替芬泰峰计算≥5000,替芬泰峰和各M8、M9 峰的分离度≥1.5,主峰的拖尾因子≤2.0。溶液的配制:精密称取供试品12.5 mg 到25 ml 量瓶中,用流动相超声溶解并稀释至刻度,作为供试品溶液;精密量取供试品溶液1 ml,用流动相溶解并稀释至100 ml,作为对照溶液。精密量取对照溶液20 μl,注入液相色谱仪,调节检测灵敏度使主成分峰高约为记录仪满量程的10%?20%。再量取供试品溶液20 μl 注入液相色谱仪,记录色谱图至主成分峰保留时间的3 倍,以主成分自身对照法计算M8、M9 含量。
1.5 观察指标
采用高效液相色谱法检测不同时间点的药代动力学参数,分析药代动力学参数、高效液相色谱特征及相关不良反应。①药代动力学参数包括最高血药浓度(Cmax)、最低血药浓度(Cmin)、平均血药浓度(Cavg)、一段时间内的血药浓度曲线面积(AUC0-t)、无穷远的血药浓度曲线面积(AUC0-∞)及积累指数(accumulation index)等。②不良反应严格按照世界卫生组织(WHO)中的药物不良反应指标及相应的分级标准,观察替芬泰对机体各个系统的影响。详细记录志愿者用药期间的消化道反应、脉搏、体温、呼吸、血压等,同时对志愿者使用药物前、中、后的电解质、肝肾功能、血常规、免疫功能、尿常规、心电图等进行检查。
1.6 统计学方法
采用统计学软件SPSS 19.0分析数据,计量资料以均数±标准差(.jpg) ±s)表示,采用t检验,以P<0.05 为差异有统计学意义。
±s)表示,采用t检验,以P<0.05 为差异有统计学意义。
2 结果
2.1 健康志愿者口服替芬泰的药代动力学情况
健康志愿者多次口服不同剂量的替芬泰片后,替芬泰的达峰时间(Tmax)为(1.02±0.13)h,半衰期(t1/2)为(3.08±0.09)h;M8的Tmax为(3.05±0.07)h,t1/2约为(9.56±0.67)h;M9的Tmax为(4.11±0.15)h,t1/2为(6.17±0.21)h。
2.2 健康志愿者不同剂量替芬泰单次给药和多次给药的药代动力学比较
300 mg 给药剂量下,替芬泰多次给药与单次给药的Cmax、Cmin、Cavg、AUC0-t、AUC0-∞、积累指数比较,差异无统计学意义(P>0.05),M8和M9 多次给药的AUC0-t和AUC0-∞高于单次给药,差异有统计学意义(P<0.05);M9 多次给药的Cmax高于单次给药,差异有统计学意义(P<0.05);M8 多次给药与单次给药的Cmax、Cmin、Cavg及积累指数比较,差异无统计学意义(P>0.05);M9 多次给药与单次给药的Cmin、Cavg及积累指数比较,差异无统计学意义(P>0.05)。600 mg 给药剂量下,替芬泰多次给药的Cmax高于单次给药,差异有统计学意义(P<0.05);替芬泰多次给药与单次给药的Cmin、Cavg、AUC0-t、AUC0-∞、积累指数比较,差异无统计学意义(P>0.05);M8和M9 多次给药的Cmax和AUC0-t高于单次给药,差异有统计学意义(P<0.05);M9 多次给药的AUC0-∞高于单次给药,差异有统计学意义(P<0.05);M8 多次给药与单次给药的Cmin、Cavg、AUC0-∞及积累指数比较,差异无统计学意义(P>0.05);M9 多次给药与单次给药的Cmin、Cavg及积累指数比较,差异无统计学意义(P>0.05)(表1)。
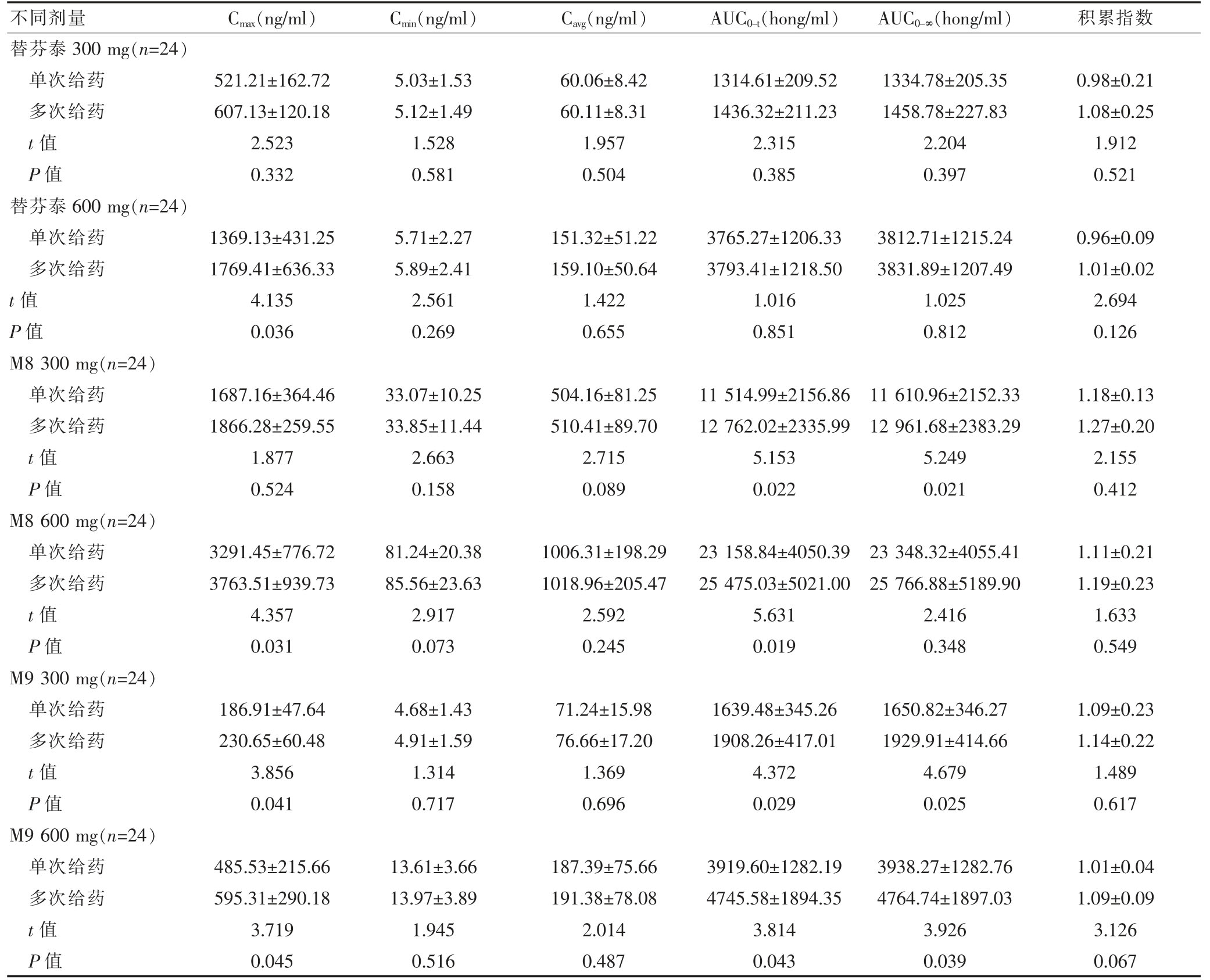
2.3 600 mg 给药剂量下替芬泰片、M8、M9的高效液相色谱图
600 mg 给药剂量下,多次给药使替芬泰Cmax升高,对其暴露量AUC0-∞没有显著影响(图1A);代谢物M8和M9的Cmax升高,同时暴露量AUC0-∞增加(图1B、C)。
2.4 健康志愿者不同剂量替芬泰的不良反应情况
健康志愿者多次口服(剂量300、600 mg)替芬泰片后,600 mg 组1例志愿者发生了1次轻度咽喉部不适,有异物感的不良事件,判定为与药物无关,无志愿者因不良事件退出试验。
3 讨论
本研究结果显示,300 mg 给药剂量下,替芬泰多次给药与单次给药的Cmax、Cmin、Cavg、AUC0-t、AUC0-∞、积累指数比较,差异无统计学意义(P>0.05),M8和M9多次给药的AUC0-t和AUC0-∞高于单次给药,差异有统计学意义(P<0.05);M9 多次给药的Cmax高于单次给药,差异有统计学意义(P<0.05);M8 多次给药与单次给药的Cmax、Cmin、Cavg及积累指数比较,差异无统计学意义(P>0.05);M9 多次给药与单次给药的Cmin、Cavg及积累指数比较,差异无统计学意义(P>0.05)。提示300 mg 给药剂量下,多次给药对替芬泰的生物利用度和体内处置结果没有显著性影响,但会使代谢物M8和代谢物M9的体内暴露量增加。
表1 健康志愿者不同剂量替芬泰单次给药和多次给药的药代动力学比较(.jpg) ±s)
±s)
本研究结果显示,600 mg 给药剂量下,替芬泰多次给药的Cmax高于单次给药,差异有统计学意义(P<0.05);替芬泰多次给药与单次给药的Cmin、Cavg、AUC0?t、AUC0-∞、积累指数比较,差异无统计学意义(P>0.05);M8和M9 多次给药的Cmax和AUC0-t高于单次给药,差异有统计学意义(P<0.05);M9 多次给药的AUC0-∞高于单次给药,差异有统计学意义(P<0.05);M8 多次给药与单次给药的Cmin、Cavg、AUC0-∞及积累指数比较,差异无统计学意义(P>0.05);M9 多次给药与单次给药的Cmin、Cavg及积累指数比较,差异无统计学意义(P>0.05)。本研究结果还显示,600 mg 给药剂量下,多次给药会使替芬泰Cmax升高,对其暴露量AUC0-∞没有显著影响;会使代谢物M8和M9的血药峰浓度升高,同时暴露量增加。提示若此浓度的药物用于患者,在患者安全耐受的情况下,AUC的提高则可使患者的治疗效果更好[16]。
替芬泰300、600 mg 多次给药后,血浆中替芬泰、代谢物M8和代谢物M9的蓄积系数在两剂量组间数值相当。根据蓄积系数的计算结果,在300、600 mg 剂量下多次给药后,替芬泰未表现出蓄积,其代谢物M8和代谢物M9 亦未表现出明显蓄积。本研究结果显示,健康志愿者多次口服(剂量300、600 mg)替芬泰片后,600 mg 组1例志愿者发生了1次轻度咽喉部不适,有异物感的不良事件,判定为与药物无关,无志愿者因不良事件退出试验。提示多次口服(剂量300、600 mg)替芬泰片在健康人群中安全性较好。
综上所述,替芬泰片600 mg 仍未表现出明显的蓄积作用,且安全性高,为了取得较好的抗病毒效果,可建议每日参考剂量为600 mg。

图1 600 mg 给药剂量下替芬泰片、M8、M9的高效液相色谱图
A:替芬泰片高效液相色谱图;B:M8 高效液相色谱图;C:M9 高效液相色谱图
[参考文献]
[1]梁吉.浅谈我国乙型肝炎现状与防治对策[J].世界最新医学信息文摘,2019,19(18):207,210.
[2]焦娇,郭意男,章国君,等.乙肝肝硬化进展原发性肝癌的危险因素研究[J].预防医学,2019,31(4):363-366,370.
[3]李翠萍.慢性乙型肝炎的诊治进展[J].基层医学论坛,2019,23(11):1583-1585.
[4]王超,林松斌,许天奖,等.乙肝病毒基因分型与原发性肝癌关系研究[J].中外医学研究,2019,17(8):3-5.
[5]苗英霞.超敏HBVDNA在慢性乙型病毒性肝炎中的临床价值研究[D].青岛:青岛大学,2018.
[6]陈洪涛,何桂蓉,杨智,等.核苷(酸)类药物治疗慢性乙型肝炎的耐药突变分析[J].新发传染病电子杂志,2019,4(1):24-27.
[7]林君,程书权,黄成军.干扰素在慢性乙型肝炎治疗中的应用[J].现代医药卫生,2018,34(24):3745-3748,3752.
[8]李晓飞.苦参素注射液联合重组人干扰素α-2b治疗84例HBeAg阳性慢性乙型肝炎的疗效观察[J].北方药学,2019,16(2):94-95.
[9]康倩锋.核苷和核苷酸类药物治疗慢性乙型肝炎的耐药情况分析及其管理[J].首都食品与医药,2019,26(5):59.
[10]刘书宏,梁尘格,向毅,等.不同核苷(酸)类药物治疗乙型肝炎相关性肝癌患者成本效益分析[J].实用肝脏病杂志,2018,21(2):293-294.
[11]冯玥,霍璇,胡金芳,等.替芬泰对HepG2 细胞的线粒体毒性[J].中国药理学通报,2017,33(9):1248-1252.
[12]樊慧蓉,慈小燕,李薇,等.抗乙肝候选新药替芬泰的体外转运机制研究[J].药学学报,2016,51(8):1233-1239.
[13]Xu Y,Huang ZM,Xu BX,et al.Effect of phenylalaninedipeptide compounds 073 on duck hepatitis B virus[J].Clin J New Drug Clin Rem,2010,29(3):217-220.
[14]Meng FC,Xu WR,Li YZ,et al.In silico molecular docking study of repensine and bentysrepinine against HBV DNA polymerase[J].Chin Herb Med,2015,7(1):39-44.
[15]王宏亮,陈盼盼,何计龙.2010年版《中国药典》奈韦拉平有关物质检查存在问题的探讨[J].国际药学研究杂志,2015,42(4):524-526,530.
[16]白楠,张杰,梅和坤,等.连续单剂静脉滴注乳酸卡德沙星在中国健康志愿者的耐受性及药代动力学[J].中国临床药理学杂志,2012,28(11):809-812.
Analysis the tolerance and pharmacokinetics of Tefentai Tablets in healthy volunteers
LIANG Hong LI Jie WU Yu-chun CHENG Nan CHEN Hua-rong WU Gui-hui▲
Department of Academic Research and Development,Guizhou Bailing Group Pharmaceutical Co.,Ltd,Guizhou Province,Anshun 561000,China
Department of Academic Research and Development,Guizhou Bailing Group Pharmaceutical Co.,Ltd,Guizhou Province,Anshun 561000,China
[Abstract] Objective To analyze the tolerance and pharmacokinetics of Tefentai Tablets in healthy volunteers. Methods In this study,a randomized,double-blind method was used to study 26 healthy volunteers from January to June 2017,all patients were given 300 and 600 mg of Tefentanil,two doses of which were given single or multiple times,once a day for multiple times,7 days in a row,in which the drug elution cycle was 2 weeks.The pharmacokinetic parameters (the highest blood concentration [Cmax],the lowest blood concentration [Cmin],the average blood concentration[Cavg],the curve area of blood concentration over a period of time [AUC0-t],the infinite curve area of blood concentration[AUC0-∞] and accumulation index) were measured by high performance liquid chromatography at different time points.Pharmacokinetic parameters,high performance liquid chromatography characteristics and related adverse reactions were analyzed. Results The peak time (Tmax) was (1.02±0.13) h,and the half-life (t1/2) was (3.08±0.09) h after taking different doses of Tifentai Tablets for many times in healthy volunteers.The Tmaxof M8 was (3.05±0.07) h and t1/2was(9.56±0.67) h;The Tmaxof M9 was (4.11±0.15) h and T1/2was (6.17±0.21) h.At the dosage of 300 mg,there were no significant differences in Cmax,Cmin,Cavg,AUC0-t,AUC0-∞and accumulation index between multiple and single administration of Tifental (P>0.05).AUC0-tand AUC0-∞in multiple administration of metabolite N-benzoyl-O-(dimethylaminoethyl)-L-tyrosine (M8) and metabolite N-benzoyl-L-tyrosine-o-(N-oxidation-dimethylaminoethyl) - L-tyrosine(M9) were significantly higher than those of single administration (P<0.05).Cmaxof M9 multiple administration was higher than that of single administration,the difference was statistically significant (P<0.05).At the dosage of 600 mg,Cmaxin Tifental of multiple administration was higher than that of single administration,the difference was statistically significant (P<0.05).There were no significant differences in Cmin,Cavg,AUC0-t,AUC0-∞,accumulation index between multiple and single administration of Tifental (P>0.05).Cmaxand AUC0-tin multiple administration of M8 and M9 were significantly higher than that of single administration,the differences were statistically significant (P<0.05).The AUC0-∞of M9 multiple administration was higher than that of single administration,the difference was statistically significant (P<0.05).At the dose of 600 mg,repeated administration increased Cmax of Tifental,but had no significant effect on AUC0-∞of its exposure.The Cmaxof metabolites M8 and M9 increased,and the exposure of AUC0-∞increased.After several times of oral administration (doses of 300 and 600 mg) of Tifentai Tablets to healthy volunteers,a case of adverse event with foreign body sensation occurred in one volunteer at the dose of 600 mg,which was determined to be unrelated to the drug,and no volunteer withdrew from the trial due to adverse event. Conclusion Tifentai Tablets 600 mg dose not show obvious accumulation effect and high safety,in order to obtain better antiviral effect,it is suggested that the daily reference dose be 600 mg.
[Key words] Tifentail Tablets;Healthy volunteers;Adverse reactions;Pharmacokinetics
[中图分类号]R96
[文献标识码]A
[文章编号]1674-4721(2020)1(b)-0004-05
[基金项目]国家科技重大专项课题(2015ZX09101012);贵州省科技计划项目(黔科合重大专项字[2015]6002 号)
[作者简介]梁弘(1989-),女,汉族,贵州安顺人,硕士,助理工程师,研究方向:中药、化学药、保健食品工艺开发
▲通讯作者:吴贵辉(1990-),男,汉族,贵州安龙人,硕士,执业药师,研究方向:化学药合成工艺路线开发
(收稿日期:2019-03-28 本文编辑:刘克明)