乳酸菌干预对帕金森病大鼠α-突触核蛋白表达的影响
张 萍1 邵 靓2 蔡新勇2 肖 斌2 梅松被2
1.江西省人民医院神经内科,江西南昌 330000;2.江西省人民医院心内科,江西南昌 330000
[摘要]目的 探讨乳酸菌干预对帕金森病大鼠α-突触核蛋白(α-synuclein)表达的影响。结果 选取50 只SD 实验鼠作为研究对象,建立帕金森病动物模型,随机分为对照组和观察组,每组各25 只。对照组采用生理盐水干预,观察组采用乳酸菌干预,观察两组α-synuclein 表达,检测炎症因子白介素-6(IL-6),白介素-1β(IL-1β),肿瘤坏死因子-α(TNF-α)的表达情况。结果 观察组α-synuclein 表达水平低于对照组,差异有统计学意义(P<0.05)。干预前,两组血清IL-6、IL-1β、TNF-α 比较,差异无统计学意义(P>0.05);干预2 周后,两组IL-6、IL-1β,TNF-α 均低于干预前,且观察组均低于对照组,差异有统计学意义(P<0.05)。结果 乳酸菌的应用,可以降低大鼠α-synuclein 的水平,抑制其表达,但是否能促进其逆向由肠至脑传递中,仍需进一步探讨。
[关键词]乳酸菌;大鼠α-突触核蛋白;逆向由肠至脑传递
帕金森病(PD)又称震颤麻痹,是常见的神经退行性疾病,主要病理表现为中脑多巴胺能神经元缺失[1]。该病突出的病理改变是中脑黑质多巴胺能神经元的变性死亡、 纹状体多巴胺含量显著性减少及黑质残存神经元胞质内出现嗜酸性包涵体(主要成分为αsynuclein 蛋白)[2]。然而,其发病机制众说纷纭,遗传因素、环境因素、年龄老化、氧化应激等均可能参与PD多巴胺能神经元的变性死亡过程[3]。本研究以乳酸菌干预宿主微生物诱导的肠源性PD 大鼠模型为基础,从肠-脑轴上证实乳酸菌通过激活巨噬细胞维持肠道微生物稳态,减少肠源性α-synuclein 蛋白的病理表达及逆向传递,探讨乳酸菌在肠-脑-PD 中的保护机制,以期为PD 起源及其发病机制提供更多的证据,为PD 预防及治疗提供理论基础和新的策略。
1 材料与方法
1.1 一般材料
1.1.1 实验动物 SD 大鼠50 只,8 周龄,雌雄各半,由南昌大学实验动物科学部提供(实验动物合格证号:SCXK-2009-2001)。建立PD 动物模型后,随机将全部SD 大鼠分为对照组和观察组,每组各25 只。
1.1.2 主要试剂 多克隆抗体(Upstate 公司);兔抗突触素多克隆抗体(Santa Cruz 公司);兔抗乳酸脱氢酶(LDH)多克隆抗体(Rockland 公司);鼠抗人α-SYN单克隆抗体(本室制备);兔抗酪氨酸羟化酶(TH)多克隆抗体(Chemicon 公司)。
1.1.3 造模过程 以不同给药方法建立PD 动物模型:①颅内直接诱导PD 模型:予鱼藤酮(河北天顺生物工程有限公司,PD 20092307),4 μg/μl,DMSO 溶剂,缓慢注入2 μl,立体定向注射制备单侧PD 模型以立体定向方式注射到黑质致密部(坐标:前囟3.08 mm、中线旁1.1 mm、硬膜下4.0 mm),用三棱针进行标记,用牙科钻小心钻透颅骨,按确定坐标将微量注射器缓慢进针到预定深度。②肠道微生物诱导PD 模型:微生物组饲养2 周后连续给予1 g/L 氨苄青霉素1 周后再连续1 周注射PD 宿主粪便提取物培养的细菌5×108 cfu 入大鼠十二指肠及胃中。③直接病理性αsynuclein 肠道诱导PD 模型;以pET 3a 为载体转染编码α-synuclein 蛋白的质粒进入大肠杆菌,在LB 培养基上繁殖大肠杆菌直到细菌密度为0.8。用0.5 mM 浓度的异丙基硫代半乳糖苷(IPTG)诱导病理性αsynuclein 蛋白表达。根据Staffan Holmqvist 文献描述方法提取α-synuclein 蛋白。将含有α-synuclein 蛋白的提取液,注射入大鼠十二指肠及胃中。④肠道鱼藤酮诱导PD 模型: 连续四周注射鱼滕酮3 mg/(kg·d)入大鼠十二指肠及胃中。
1.2 方法
观察组采用乳酸菌(山西省偏关县申夏乳酸有限公司,国药准字H10980293)干预,连续2 周给予5 ml含5×108 cfu 的乳酸干酪菌的饮用水。对照组采用生理盐水干预,给予同样剂量的生理盐水灌胃。
1.3 观察指标
Western blot 观察组织中α-synuclein 表达情况:TH 染色观察中脑黑质区、纹状体区及肠上皮神经元:TH 是多巴胺合成的限速酶,在黑质区主要分布于多巴胺能神经元中,多巴胺能神经元主要投射到纹状体区,TH 染色采取普通免疫和荧光免疫后观察多巴胺能神经元的分布情况。
抽取实验鼠3 ml 静脉血,行抗凝处理,并于1500 r/min 环境下离心处理15 min,静置10 min 后取血清,保存于-20℃的冰箱中,及时送检。采用酶联免疫吸附法(ELISA)检测各炎症因子水平,包括白介素6(interleukin-6,IL-6),白介素1β(interleukin-1β,IL-1β),肿瘤坏死因子-α(tumor necrosis factor,TNFα)等。
1.4 统计学方法
使用SPSS 21.0 统计学软件处理数据,计量资料采用(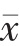 ±s)表示,组间比较采用t 检验,以P<0.05 为差异有统计学意义。
±s)表示,组间比较采用t 检验,以P<0.05 为差异有统计学意义。
2 结果
2.1 两组α-synuclein 表达水平的比较
干预2 周后,观察组的α-synuclein 表达水平低于对照组,差异有统计学意义(P<0.05)(图1)。
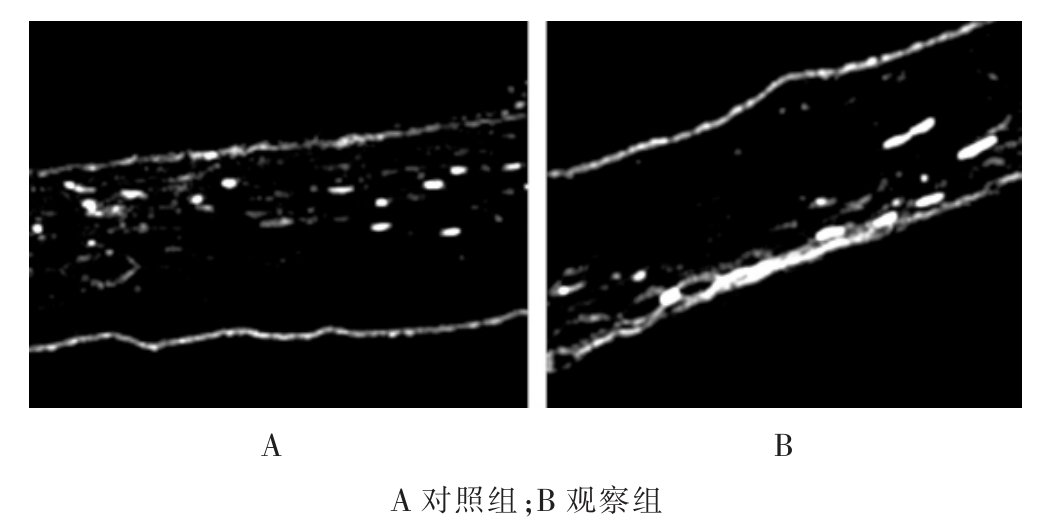
图1 两组干预后α-synuclein 表达情况(TH 染色,200×)
2.2 两组各炎性反应指标的比较
干预前,两组的血清IL-1β、IL-6、TNF-α 炎性指标比较,差异无统计学意义(P>0.05);干预后两组的血清IL-1β、IL-6、TNFα-均低于干预前,且观察组均低于对照组,差异有统计学意义(P<0.05)(表1)。
表1 两组炎性反应指标的比较(pg/ml,.jpg) ±s)
±s)
3 讨论
乳酸菌是一种对宿主有益的活性微生物,是定植于人体肠道、生殖系统内,能产生确切健康功效从而改善宿主微生态平衡、发挥有益作用[4]。首先,乳酸菌产生的乳酸等有机酸能显著降低环境pH 值和氧化还原电位(Eh)值,使肠内处于酸性环境,对于致病菌如痢疾杆菌、伤寒杆菌、副伤寒杆菌、弯曲杆菌、葡萄球菌等有拮抗作用[5]。其次,产生的过氧化氢能激活牛乳中的“过氧化氢酶-硫氰酸”系统,抑制和杀灭革兰阴性菌、过氧化氢酶阳性细菌如假单胞菌属、大肠杆菌类和沙门菌属等[6]。而且,产生类似细菌素的细小蛋白质或肽类(抗菌肽),如各种乳酸杆菌素和双歧菌素,对葡萄球菌、梭状芽孢杆菌及沙门菌和志贺菌有拮抗作用[7]。但最重要的是乳酸杆菌能显著激活巨噬细胞的吞噬作用,定植在肠道,相当于天然自动免疫,杀灭肠道有害微生物[8-9]。
乳酸菌刺激巨噬细胞、诱导产生干扰素、促进细胞分裂及促进细胞免疫等,增强机体的非特异性和特异性免疫反应,提高肠道抗菌能力,维持肠道微生物稳态[10-11]。口服乳酸菌后,对肠道巨噬细胞的半乳糖甙酶活性、巨噬细胞的吞噬活性等有显著的激活和促进作用[12]。当异物侵入机体时,免疫细胞被乳酸菌激活,增强了宿主肠道对异物产生抵抗的作用[13-14]。然而,乳酸菌是否能通过减少宿主肠道微生物诱导的肠源性病理性α-synuclein 蛋白表达,抑制病理性α-synuclein 蛋白肠-脑逆向传递,进而减少PD 的发生,还未有明确结论[15]。本研究结果显示,在实施乳酸菌治疗后,大鼠的α-synuclein 表达水平有了明显降低,且作用强于生理盐水,提示乳酸菌在大鼠α-synuclein 逆向由肠至脑传递作用中,是通过降低其水平实现的。另外在IL-1β、IL-6、TNF-α 等炎症因子指标,乳酸菌组均低于生理盐水组,提示了乳酸菌在抑制炎症反应方面的效果。
综上所述,乳酸菌具有多种功效,定植在肠道,相当于天然自动免疫。当异物侵入机体时,免疫细胞被乳酸菌激活,增强了宿主肠道对异物产生抵抗的作用。本研究结果提示,乳酸菌可以通过减少宿主肠道微生物诱导的肠源性病理性α-synuclein 蛋白表达,抑制病理性α-synuclein 蛋白-肠-脑逆向传递,进而减少PD 的发生。
[参考文献]
[1]杨斌,杨巍巍,李昕,等.α-突触核蛋白和硝基化α-突触核蛋白在不同年龄段食蟹猴结肠中的表达[J].首都医科大学学报,2014,35(2):214-218.
[2]Delamarre A,Meissner WG.Epidemiology,environmental risk factors and genetics of Parkinson′s disease[J].Presse Med,2017,46(2Pt1):175-181.
[3]Tysnes OB,Storstein A.Epidemiology of Parkinson′s disease[J].J Neural Transm (Vienna),2017,124(8):901-905.
[4]何婧,黄燕,杜果,等.慢性脑低灌注致模型大鼠学习记忆受损及海马α-突触核蛋白变化[J].中国组织工程研究,2018,22(20):3230-3236.
[5]Lee JM,Derkinderen P,Kordower JH,et al.The search for a peripheral biopsy indicator of α-synuclein pathology for Parkinson disease[J].J Neuropathol Exp Neurol,2017,76(1):2-15.
[6]黄宁静,Wei JN,李文涛.止颤汤参与帕金森病大鼠自噬途径中P62 调节α-突触核蛋白的研究[J].中西医结合心脑血管病杂志,2017,15(21):2689-2692.
[7]Stokholm MG,Danielsen EH,Hamilton-Dutoit SJ,et al.Pathological α-synuclein in gastrointestinal tissues from prodromal Parkinson disease patients[J].Ann Neurol,2016,79:940-949.
[8]许文年.左旋多巴对帕金森病大鼠海马区酪氨酸羟化酶及α-突触核蛋白表达的影响[J].中国老年学杂志,2016,36(7):1556-1558.
[9]Kab S,Spinosi J,Chaperon L,et al.Agricultural activities and the incidence of Parkinson′s disease in the general French population[J].Eur J Epidemiol,2017,32(3):203-216.
[10]陈施吾,王刚.帕金森病与肠道菌群关系的研究进展[J].内科理论与实践,2018,13(5):61-64.
[11]赵振向,李晔,刘怡琳,等.帕金森病肠道起源的研究进展[J].山东医药,2017,57(12):107-109.
[12]Sampson TR,Debelius JW,Thron T,et al.Gut microbiota regulate motor deficits and neuroinflammation in a model of Parkinson′s disease[J].Cell,2016,167(6):1469-1480.
[13]毕树立,刘斌,高海英.左旋多巴对帕金森病模型大鼠结肠酪氨酸羟化酶和ɑ-突触核蛋白表达的影响[J].疑难病杂志,2014,12(10):1047-1050.
[14]胡景霞,白波.脑-肠-微生物群轴与帕金森病[J].济宁医学院学报,2016,39(2):77-81.
[15]Hill-Burns EM,Debelius JW,Morton JT,et al.Parkinson′s disease and Parkinson′s disease medications have distinct signatures of the gut microbiome[J].Mov Disord,2017,32(5):739-749.
Effect of lactobacillus intervention on expression of α -synuclein in Parkinson′s disease rats
ZHANG Ping1 SHAO Liang2 CAI Xin-yong2 XIAO Bin2 MEI Song-bei2
Department of Neurology,Jiangxi Provincial People′s Hospital,Nanchang 330000.China;2.Department of Cardiology,Jiangxi Provincial People′s Hospital,Nanchang 330000,China
Department of Neurology,Jiangxi Provincial People′s Hospital,Nanchang 330000.China;2.Department of Cardiology,Jiangxi Provincial People′s Hospital,Nanchang 330000,China
[Abstract]Objective To investigate the effect of lactobacillus intervention on the expression of α-synuclein in rats with Parkinson′s disease.Methods A total of 50 SD rats were selected as subjects to establish an animal model of Parkinson′s disease,and randomly divided into control group and observation group,25 rats in each group.The control group was treated with normal saline,while the observation group was treated with lactic acid bacteria.The expression of α-synuclein,interleukin-6 (IL-6),interleukin-1β (IL-1β),and tumor necrosis factor-α (TNF-α) in the two groups were observed.Results The expression level of α-synuclein in the observation group was lower than that in the control group,with statistically difference (P<0.05).Before intervention,serum IL-6,IL-1β,TNF-α in the control group and the observation group showed no significant difference (P>0.05).At 2 weeks after intervention,IL-6,IL-1β,TNF-α were lower in both groups than before intervention and the observation group was lower than the control group,the differences were statistically significant (P<0.05).Conclusion The application of lactic acid bacteria can reduce the level of α-synuclein in rats and inhibit its expression,but whether it can promote its reverse transmission from the intestine to the brain still needs to be further explored.
[Key words] Lactobacillus;Rat α-synuclein;Reverse transmission from intestine to brain
[中图分类号] R742.5
[文献标识码] A
[文章编号] 1674-4721(2019)9(c)-0035-03
[基金项目]江西省卫生计生委科技计划项目(20191002)
(收稿日期:2019-04-24 本文编辑:崔建中)